Trapianto di cellule staminali autologhe e allogeniche in epoca COVID-19
Stefania Bramanti
Ematologia, Humanitas Cancer Center, Humanitas Clinical and Research Hospital, IRCCS Rozzano (MI)
Tutti gli ematologi e trapiantologi d’Italia hanno ricevuto il documento condiviso SIE/GITMO aggiornato che facendo riferimento a quanto emanato dal CNT/CNS, tenta di armonizzare le procedure di gestione del paziente trapiantato e del paziente candidato a trapianto, nonché del donatore allogenico (Allegato 1).
Tuttavia, l’Italia in questo momento presenta una differente epidemiologia rispetto all’infezione e differenti programmi di gestione della strategia diagnostica e assistenziale dei pazienti affetti da COVID.
In particolare, ogni Regione ha emanato differenti criteri di utilizzo dei test diagnostici a disposizione, in particolare dei tamponi, e ha individuato dei criteri stringenti per l’utilizzo degli stessi.
Anche i dispositivi di sicurezza in dotazione per il personale e per i pazienti risentono di una grande variabilità, lasciata alla Direzione Sanitaria dei singoli ospedali.
Troppo “minimalista” rispetto alle esigenze appare la sorveglianza del problema contagi in asintomatici e paucisintomatici sul territorio, soprattutto nelle regioni più colpite come la Lombardia.
Per tutti questi motivi, la valutazione dei dati a disposizione non consente di avere un supporto basato su evidenza scientifica comprovata nelle decisioni da prendere quotidianamente.
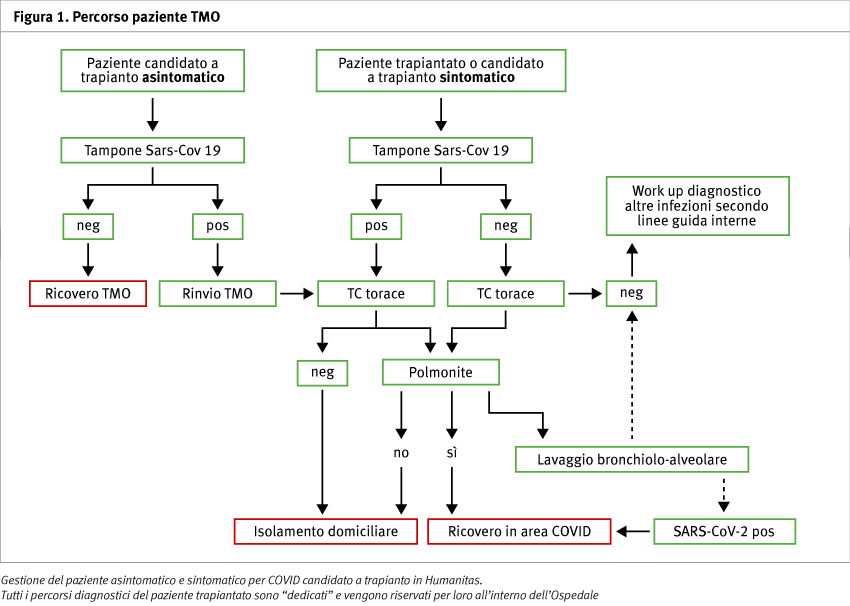
Ancor meno evidenza scientifica sembra esserci sulla gestione del COVID in un contesto di trapianto allogenico e di immunodepressi. Al contrario, e inesorabilmente, la prognosi delle malattie ematologiche ad alto rischio (leucemie acute mieloidi e linfoidi, linfomi refrattari, ecc.), non subisce alcuna modifica, sia all’esordio, sia in corso di trattamento chemioterapico. Pertanto va mantenuto saldo il principio per cui il trapianto allogenico va erogato nei tempi adeguati per consentire uguale efficacia anche in tempo di coronavirus. In corso di pandemia va seguito il principio di fare tamponi naso faringei per la ricerca di COVID-19 a tutti i pazienti prima dell’ingresso in reparto per trapianto autologo e allogenico, prima di aferesi, e ai donatori familiari prima della raccolta, congelando le cellule staminali per almeno 14 giorni, in modo da iniziare il condizionamento in assoluta sicurezza (Figure 1 e 2).

Ancora più complesso il percorso seguito da una sacca di cellule staminali in caso di donatore volontario non italiano, che, oltre a ricevere i controlli suddetti risente di una logistica di trasporto ridotta e a volte impossibile a causa dei confini chiusi e delle diverse politiche di gestione della pandemia da parte del governo degli altri paesi. Inoltre, per il SSN sono aumentati notevolmente i costi (fino a raddoppiarsi) dei trasporti di cellule a fresco.
L’esecuzione dei tamponi, la necessità di criopreservazione e la difficoltà di trasporto di cellule tra un confine e l’altro, sia all’interno sia all’esterno dell’Europa, ha modificato i tempi e le modalità di ricerca del donatore. Nel nostro centro, per ovviare a questo abbiamo ridisegnato l’algoritmo di ricerca del donatore: prediligendo donatori familiari HLA id aplo, restringendo la ricerca del donatore volontario e del cordone ombelicale al solo registro italiano (Figura 2).
Inoltre, a seconda delle patologie per cui è indicato il trapianto, abbiamo proceduto ad anticipare i tempi di raccolta del donatore di un mese rispetto al termine della terapia di induzione, per non rischiare ritardi e mancate idoneità. (Vedi paragrafo per patologie per approfondimento).
Per quanto concerne invece l’attività di trapianto autologo, non vi sono state particolari complessità e si tende a seguire le consuete procedure.
Leucemie acute linfoblastiche e leucemie acute mieloidi ad alto rischio e a rischio intermedio all’esordio
Tutti i pazienti con età inferiore o uguale a 70 anni sono candidati a fare un trapianto allogenico da donatore in prima remissione completa (RC). Si procede alla ricerca del donatore allogenico HLA identico o aploidentico familiare alla diagnosi. Si interroga IBMDR (Italian Bone Marrow Donor Registry) alla ricerca di un donatore 10/10 italiano.
Alla fine dell’induzione, se in RC, il donatore identificato a scelta tra HLA identico familiare, HLA identico volontario italiano disponibile nell’arco di 15 giorni, o aploidentico familiare, sarà reso idoneo secondo procedura in epoca COVID, raccolto e criopreservato.
Allo scadere di 14-21 giorni del consolidamento o dei consolidamenti che il paziente intanto eseguirà, sarà programmato il condizionamento per il trapianto allogenico.
Non sarà interrogato il registro straniero, in caso di assenza di altri donatori sarà utilizzato un cordone ombelicale, se presente in un registro italiano e se compatibile con il peso del ricevente.
Linfomi recidivati o refrattari
Tutti i pazienti con età inferiore o uguale a 70 anni affetti da linfoma recidivato/refrattario dopo prima linea saranno arruolati nel protocollo Belinda per il random trapianto autologo vs CAR-T .
Tutti i pazienti con età inferiore o uguale a 70 anni affetti da linfoma reicidivato/refrattario dopo seconda linea saranno avviati a CAR-T secondo indicazioni AIFA oppure a terapia di salvataggio secondo protocolli di fase I e II presenti localmente. Tutti i linfomi che otterranno una RC con terapie di salvataggio che non comprendono CAR-T, saranno candidati a fare un trapianto allogenico da donatore; pertanto all’inizio del programma terapeutico di salvataggio si procederà alla ricerca del donatore allogenico HLA identico o aploidentico familiare e si interrogherà IBMDR alla ricerca di un donatore 10/10 italiano.
Al momento della rivalutazione intermedia prevista in protocollo in caso di remissione parziale o completa, il donatore identificato a scelta tra HLA identico familiare, HLA identico volontario italiano disponibile nell’arco di 15 giorni, o aploidentico familiare, sarà reso idoneo secondo procedura in epoca COVID, raccolto e criopreservato.
Allo scadere del tempo del completamento del percorso di cura che porterà alla RC che il paziente intanto eseguirà, sarà programmato il condizionamento per il trapianto allogenico.
Non sarà interrogato il registro straniero; in caso di assenza di altri donatori sarà utilizzato un cordone ombelicale, se presente in un registro italiano e se compatibile con il peso del ricevente.
Mielodisplasia e malattie mieloproliferative croniche
Le mielodisplasie (MDS) a rischio intermedio e alto secondo IPSS, andranno assimilate alla leucemia acuta.
Le MDS a rischio intermedio e basso andranno valutate caso per caso ed eventualmente rimandate.
Fase di aplasia post-trapianto
Le Degenze di Trapianto sono tutte dotate di stanze a pressione positiva, i pazienti ricoverati sono tutti COVID-free.
Nessun ingresso dall’esterno è consentito, le visite dei parenti annullate.
È stato programmato un tentativo di riduzione al massimo degli ingressi degli operatori nelle stanze in questo modo:
- gli operatori sanitari in turno nella degenza saranno sempre gli stessi e non sarà concesso quindi di fare turni in reparti COVID
- gli accessi nelle stanze saranno ridotti al minimo, i prelievi, se non necessari, saranno fatti a giorni alterni e la rilevazione dei parametri solo da parte degli infermieri
- gli ausiliari lavoreranno fuori dalle stanze ed entreranno solo per la distribuzione dei pasti
- tutti i pazienti e gli operatori indosseranno mascherina chirurgica
- gli esami diagnostici che prevedono l’uscita dalla stanza a pressione positiva saranno concordati ed effettuati solo se strettamente necessari
- la turnistica del week end è coperta solo da medici interni al trapianto
- i parenti saranno avvisati telefonicamente della situazione del malato ricoverato
- sarebbe auspicabile una sorveglianza con tamponi e/o sierologia a cadenza settimanale degli operatori del centro trapianto; se non possibile un responsabile identificato si occuperà di segnalare operatori con lievi sintomi ILI (influenza-like illness), per sottoporli a tampone e allontanarli se positivi
- il personale sarà diviso in squadre di lavoro che non si incontrano.
Fase post-trapianto
La gestione della fase post-trapianto con la riammissione in comunità del paziente trapiantato è la più delicata poiché non conosciamo la sintomatologia che un paziente trapiantato potrà sviluppare in caso di infezione COVID-19 e sappiamo che la febbre è l’evenienza più comune nei primi tre mesi dal trapianto.
La definizione di paziente sospetto risponderà a uno o più dei seguenti criteri:
- paziente con febbre non responsiva a terapia antibiotica empirica con levofloxacina al domicilio, senza sintomi respiratori
- paziente con febbre e con sintomi respiratori anche lievi ILI like
- pazienti senza febbre con sintomi ILI
- pazienti con polmonite alla TAC.
Tali pazienti beneficeranno di un percorso dedicato fino alla diagnosi del COVID19, in caso di malattia conclamata saranno gestiti in ambiente COVID+.
In assenza di COVID, completeranno il percorso diagnostico della febbre come da linee guida interne, ricoverati in ematologia (Figura 1).