Numero speciale di "Impact Factor News” n° 4 - Ottobre 2020
Introduzione
La linfoistiocitosi emofagocitica primaria è una sindrome rara caratterizzata da disregolazione immunitaria e iper-infiammazione. Si manifesta tipicamente nell'infanzia ed è associata ad alta mortalità. Nessun farmaco è stato approvato per la linfoistiocitosi emofagocitica, ma i glucocorticoidi e l'etoposide, con o senza ciclosporina, studiati dalla Histiocyte Society sono diventati la terapia convenzionale. Evidenze scientifiche crescenti forniscono supporto per il ruolo fondamentale nella patogenesi dell'interferone (IFN)-γ nella linfoistiocitosi emofagocitica. Livelli elevati di IFN-γ nei pazienti con questa sindrome corrispondono a malattia attiva, e la sua neutralizzazione nei modelli di linfoistiocitosi emofagocitica nei topi ha permesso alla maggior parte di questi ultimi di sopravvivere, riducendo i segni e i sintomi, o entrambi. Emapalumab è un anticorpo IgG1 anti-IFN-γ monoclonale, completamente umano, che si lega all'IFN-γ libero e legato al recettore (inibendo la dimerizzazione del recettore e trasduzione del segnale dell'IFN-γ) e neutralizza la sua attività biologica. In questo lavoro gli autori hanno testato prospetticamente la sicurezza e l'efficacia di dosi multiple ev di emapalumab in pazienti con linfoistiocitosi emofagocitica primaria.
Metodi
In questo studio gli sperimentatori hanno riportato i risultati in termini di efficacia e sicurezza di emapalumab, somministrato con desametasone, in uno studio di fase II/III, in aperto, a singolo braccio, che ha coinvolto pazienti affetti da linfoistiocitosi emofagocitica primaria sia treatment naïve sia quelli che avevano ricevuto una prima linea di terapia convenzionale prima dell'arruolamento, di età ≤18 anni. La dose iniziale di emapalumab era di 1 mg per kg di peso corporeo ogni tre giorni e le modifiche della dose sono state inizialmente guidate da valutazioni cliniche e farmacocinetiche. Il periodo di trattamento pianificato era di otto settimane, che poteva comunque essere abbreviato o esteso, se necessario e se fattibile, in base alla tempistica del trapianto allogenico di cellule staminali ematopoietiche (HSCT). I pazienti candidati a un trapianto allogenico successivo al trattamento potevano entrare in uno studio di follow-up a lungo termine fino a un anno dopo il trapianto; i pazienti non candidabili a un trapianto, invece, a un follow-up fino a un anno dall'ultima dose di emapalumab somministrata. L'endpoint primario di efficacia è stato fissato nel rate di risposte globali, che è stato valutato nei pazienti trattati al termine delle dosi pianificate e/o realmente ricevute, secondo criteri clinici e di laboratorio oggettivi. Studio finanziato da NovImmune e dalla Commissione europea; numeri NI-0501-04 e NI-0501-05 registrati su ClinicalTrials.gov, NCT01818492. Nuova scheda e NCT02069899.
Risultati
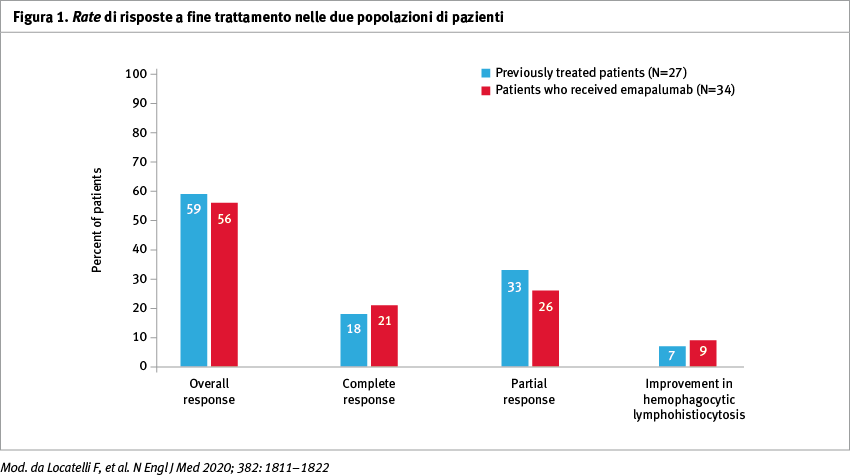
Alla data limite del 20 luglio 2017 un totale di 34 pazienti (27 precedentemente trattati e 7 treatment naïve) avevano ricevuto emapalumab; di questi, 26 hanno completato lo studio. Un totale del 63% dei pazienti trattati in precedenza e il 65% dei pazienti che hanno ricevuto un'infusione di emapalumab hanno avuto una risposta; queste percentuali erano significativamente superiori all'ipotesi prespecificata del disegno dello studio pari al 40% (p=0,02 e p=0,005, rispettivamente) (Figura 1).
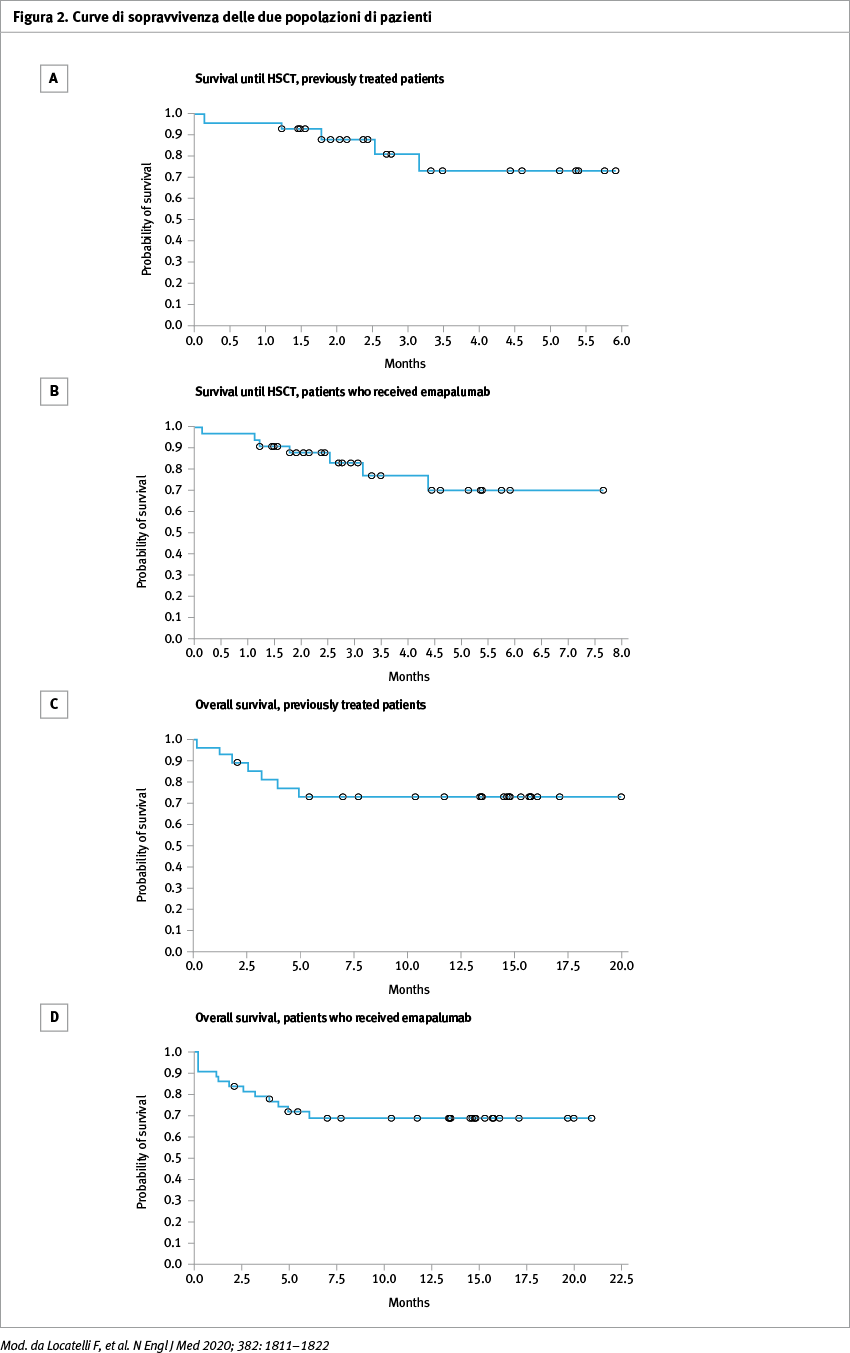
Hanno potuto procedere al trapianto il 70% dei pazienti nel gruppo in seconda linea e il 65% dei pazienti nel gruppo in prima linea che hanno ricevuto emapalumab. All'ultima osservazione, il 74% dei pazienti in seconda linea e il 71% dei pazienti che avevano ricevuto emapalumab erano vivi (Figura 2).
Emapalumab non è stato associato ad alcuna tossicità d'organo. Per quanto riguarda le tossicità extraematologiche, 10 pazienti hanno sviluppato infezioni di grado 3–4 durante il trattamento con emapalumab. Il farmaco sperimentale è stato interrotto in un paziente a causa di istoplasmosi disseminata.
Conclusioni
In questo studio emapalumab è risultato efficace con un basso livello di effetti tossici nei pazienti con linfoistiocitosi emofagocitica primaria. Lo studio fornisce supporto per ulteriori indagini su emapalumab nei pazienti con linfoistiocitosi emofagocitica primaria in cui l'IFN-γ è stato identificato come causa eziologica.


