Numero speciale di "Impact Factor News” n° 4 - Ottobre 2022
Introduzione
Pazienti affetti da linfoma mantellare (MCL) non candidabili a chemioterapia ad alte dosi come consolidamento della prima linea di trattamento sono stati trattati con immunochemioterapia e trattamento di mantenimento con rituximab. In tal senso, trial recenti hanno studiato un approccio “libero da chemioterapia” nel MCL. Due gruppi hanno testato ibrutinib in associazione a rituximab come prima linea, ottenendo dei dati promettenti. Sulla scorta di questi dati iniziali, gli sperimentatori hanno testato l’efficacia clinica di ibrutinib somministrato in combinazione con bendamustina e rituximab e seguito da terapia di mantenimento con rituximab nei pazienti più anziani con linfoma mantellare non trattato.
Metodi
In questo trial di fase III, pazienti di età pari o superiore a 65 anni sono stati randomizzati a ricevere ibrutinib (560 mg, somministrato per via orale una volta al giorno fino a progressione della malattia o effetti tossici inaccettabili) o placebo più sei cicli di bendamustina (90 mg/m2) e rituximab (375 mg/m2). I pazienti con una risposta obiettiva (completa o parziale) sono stati avviati a una terapia di mantenimento con rituximab, somministrata ogni 8 settimane per un massimo di 12 dosi aggiuntive. L'obiettivo primario è stata la sopravvivenza libera da progressione (PFS) valutata dai ricercatori. Sono state, inoltre, valutate la sopravvivenza globale (OS) e la sicurezza (NCT01776840).
Risultati
Dei 523 pazienti arruolati, 261 sono stati assegnati in modo casuale a ricevere ibrutinib e 262 a ricevere placebo. A un follow-up mediano di 84,7 mesi, la PFS mediana è stata di 80,6 mesi nel gruppo ibrutinib e di 52,9 mesi nel gruppo placebo (hazard ratio per la progressione della malattia o la morte, 0,75; confidence interval, CI 95%: 0,59–0,96; p=0,01) (Figura 1).
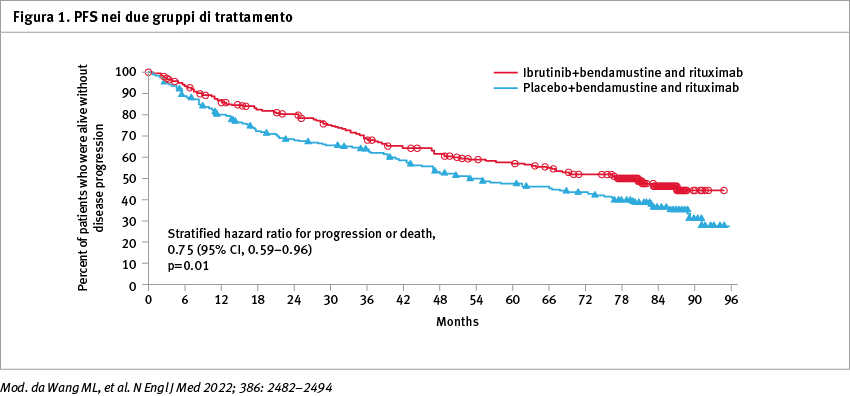
La percentuale di pazienti con una risposta completa è stata del 65,5% nel gruppo ibrutinib e del 57,6% nel gruppo placebo (p=0,06). L’OS è stata simile nei due gruppi. L'incidenza di eventi avversi di grado 3 o 4 durante il trattamento è stata dell'81,5% nel gruppo ibrutinib e del 77,3% nel gruppo placebo. Tra gli eventi avversi di interesse clinico per gli inibitori della tirosin-chinasi di Bruton (BTK), la fibrillazione atriale è stata segnalata nel 13,9% dei pazienti nel gruppo ibrutinib e nel 6,5% di quelli nel gruppo placebo; l’ipertensione nel 13,5 e nell'11,2%, rispettivamente; la diarrea nel 46,3 e nel 36,9%; l’emorragia maggiore nel 5,8 e nel 4,2% e l’artralgia nel 17,4 e nel 16,9%. La polmonite da Pneumocystis è stata osservata in un paziente in ciascun gruppo e l'infezione da Aspergillus è stata diagnosticata in quattro pazienti nel gruppo ibrutinib e in un paziente nel gruppo placebo. Durante il periodo di trattamento, si sono verificati eventi avversi considerati come principale causa di morte in 28 pazienti (10,7%) nel gruppo ibrutinib e in 16 (6,1%) nel gruppo placebo. Tra questi eventi, la morte per disturbi cardiaci si è verificata in tre pazienti nel gruppo ibrutinib e in cinque nel gruppo placebo.
Conclusioni
Il trattamento con ibrutinib in combinazione con la chemioimmunoterapia standard ha prolungato significativamente la PFS. Il profilo di sicurezza della terapia combinata è stato coerente con i profili noti dei singoli farmaci.


