Numero speciale di "Impact Factor News” n° 4 - Ottobre 2022
Introduzione
La malattia da agglutinine fredde (CAD) è un raro tipo di anemia emolitica autoimmune caratterizzata da emolisi cronica, interamente mediata dall'attivazione della via classica del complemento. La CAD è una malattia linfoproliferativa clonale di basso grado che può essere rilevata nel sangue o nel midollo in pazienti senza evidenza clinica o radiologica di condizioni maligne. I pazienti con CAD possono manifestare sintomi mediati dal complemento, inclusa l'emolisi cronica, con conseguente anemia, affaticamento profondo e ittero. I sintomi non mediati dal complemento includono sintomi circolatori transitori, indotti dal freddo e mediati dall'agglutinazione, come acrocianosi e fenomeno di Raynaud. I pazienti con CAD hanno anche un aumentato rischio di tromboembolismo e mortalità precoce. Il complesso anticorpale antigene-IgM, un potente innesco della via classica del complemento, si lega al complesso del complemento C1, determinando l'attivazione di C1 (una proteasi della serina del complesso C1), che attiva C2 e C4, a sua volta generando la C3 convertasi, con conseguente scissione di C3 in C3a e C3b. Sutimlimab (BIVV009; TNT009) è un anticorpo monoclonale di tipo immunoglobulina G4 (IgG4), umanizzato, di prima classe, progettato per inibire selettivamente la via classica del complemento a C1, con l’effetto di interrompere rapidamente l'emolisi (come riportato nello studio CARDINAL a singolo braccio in pazienti con CAD recentemente trasfusi).
Metodi
Il trial CADENZA è uno studio di fase III randomizzato, controllato con placebo, della durata di 26 settimane, disegnato per valutare la sicurezza e l'efficacia di sutimlimab nei pazienti con CAD senza recente storia trasfusionale (entro sei mesi prima dell'arruolamento). Per l'endpoint primario composito, sutimlimab è stato confrontato con il placebo utilizzando il metodo Cochran-Mantel-Haenszel. Questo studio è stato registrato con il numero identificativo NCT03347422.
Risultati
Sessantasei pazienti sono stati selezionati e 42 sono stati randomizzati a ricevere sutimlimab (n=22) o placebo (n=20) nei giorni 0, 7 e poi ogni due settimane. I criteri compositi dell'endpoint primario (aumento dell'emoglobina >1,5 g/dL al momento della valutazione del trattamento [media delle settimane 23, 25, 26], indipendenza dalle trasfusioni e dalla terapia per CAD non prevista dallo studio [settimane 5–26]) sono stati soddisfatti da 16 pazienti (73%) nella coorte con sutimlimab e da 3 pazienti (15%) nella coorte placebo (odds ratio, OR 15,9; confidence interval, CI 95%: 2,9–88,0; p <0,001) (Figura 1).
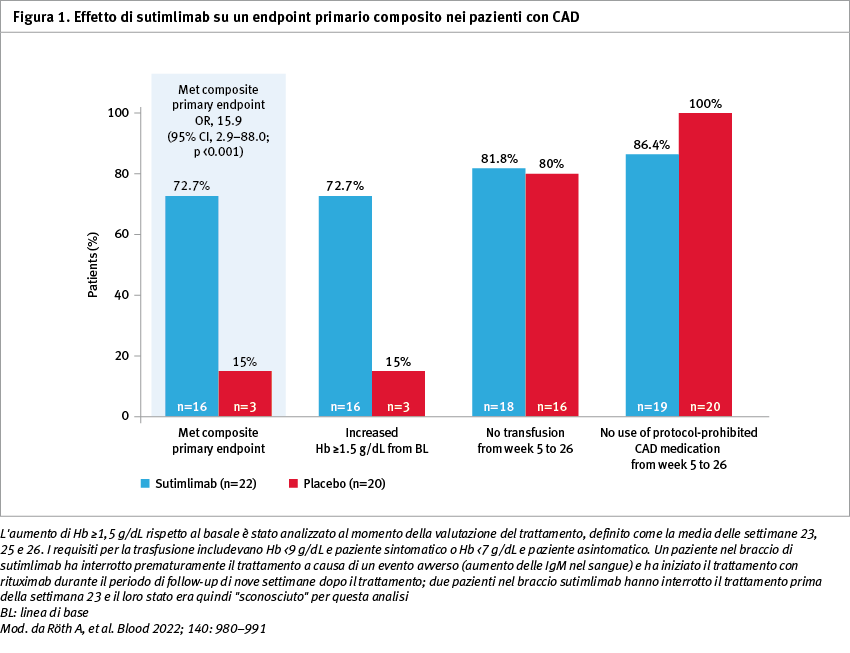
I pazienti che hanno ricevuto 26 settimane di trattamento con sutimlimab hanno avuto probabilità significativamente maggiori di raggiungere i criteri di risposta definiti nell'endpoint primario composito rispetto ai pazienti che hanno ricevuto il placebo (OR 15,9; CI 95%: 2,9–88,0; p <0,001). La coorte che ha ricevuto sutimlimab ha dimostrato un aumento significativo dei livelli di emoglobina media e dei punteggi di functional assessment of chronic illness therapy (FACIT)-Fatigue durante il trattamento. Sutimlimab ha normalizzato i livelli di bilirubina entro la settimana 1. Questo grazie all'inibizione quasi completa della via classica del complemento (2,3% di attività media alla settimana 1) e alla normalizzazione di C4. Per quanto riguarda i dati di tollerabilità, 21 pazienti (96%) del gruppo sutimlimab e 20 pazienti (100%) del gruppo placebo hanno sperimentato almeno un evento avverso legato al trattamento. Mal di testa, ipertensione, rinite, fenomeno di Raynaud e acrocianosi sono stati maggiormente frequenti con sutimlimab rispetto al placebo, con una differenza di >3 pazienti tra i due gruppi. Tre pazienti hanno interrotto sutimlimab a causa di eventi avversi, mentre nessun paziente ha interrotto il trattamento nella coorte placebo.
Conclusioni
In conclusione, i dati dello studio CADENZA confermano che l'inibizione mirata di C1 può essere un trattamento efficace e ben tollerato per i pazienti con CAD. Questi dati mostrano che il targeting della via classica del complemento nei siti di C1 rappresenta un nuovo ed efficace approccio terapeutico per la gestione della CAD, indipendentemente dallo stato trasfusionale, con risposte al trattamento già alla settimana 1 e un profilo di tollerabilità favorevole.


