Introduzione
I pazienti con leucemia mieloide cronica (LMC) di nuova diagnosi necessitano di una terapia a lungo termine con elevata efficacia e sicurezza. Asciminib è il primo inibitore Specifically Targeting the ABL Myristoyl Pocket (STAMP), una molecola disegnata per migliorare l’efficacia e la sicurezza degli inibitori di BCR::ABL tradizionali, ed è attualmente approvato per il tratamento della LMC a partire dalla terza linea. Nello studio ASC4FIRST asciminib è stato confrontato con gli inibitori della tirosin-chinasi (TKI), attualmente standard of care (SoC), di prima generazione (imatinib) o di seconda generazione (nilotinib, dasatinib e bosutinib) selezionati dallo sperimentatore, nei pazienti con LMC in fase cronica Philadelphia-positiva (Ph+ LMC-CP) di nuova diagnosi.
Metodi
Lo studio ASC4FIRST di fase 3 ha randomizzato pazienti con LMC di nuova diagnosi con rapporto 1:1 a ricevere asciminib (80 mg una volta al giorno) o un TKI SoC selezionato dallo sperimentatore. La randomizzazione è stata stratificata in base alla categoria di rischio a lungo termine dello European Treatment and Outcome Study (basso, intermedio o alto rischio) e in base al TKI selezionato dallo sperimentatore prima della randomizzazione (inclusi imatinib e i TKI di seconda generazione dasatinib, nilotinib e bosutinib). I due endpoints primari dello studio sono stati il confronto dell’efficacia di asciminib rispetto ai TKI SoC selezionati dallo sperimentatore (TKI di prima e seconda generazione) e il confronto dell’efficacia di asciminib rispetto ai pazienti trattati solo con imatinib come TKI selezionato pre-randomizzazione, in base alla proporzione di pazienti che raggiungono la risposta molecolare maggiore (MMR) alla settimana 48 (MMR definita come livelli di trascritti BCR::ABL1 ≤0,1% sulla scala internazionale).
Risultati
In totale, 201 pazienti sono stati assegnati a ricevere asciminib e 204 a ricevere un TKI selezionato dallo sperimentatore. Il follow-up mediano era di 16,3 mesi nel gruppo asciminib e 15,7 mesi nel gruppo TKI. Con asciminib si osservava una percentuale maggiore di MMR alla settimana 48 rispetto al gruppo globale dei pazienti trattati con TKI SoC (MMR pari al 67,7% con asciminib rispetto al 49,0%; differenza: 18,9 %; confidence interval [CI] 95%: 9,6–28,2; p <0.001). Analogamente, confrontando il gruppo asciminib con i soli pazienti trattati con imatinib si riscontrava una differenza di 29,6 punti nella percentuale di MMR a vantaggio dei pazienti che ricevevano asciminib (CI 95%: 16,9–42,2; p <0.001) (Figura 1).
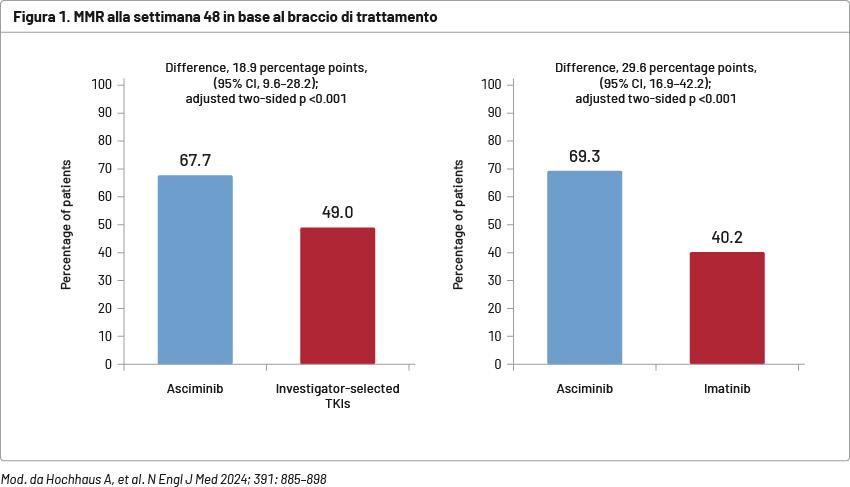
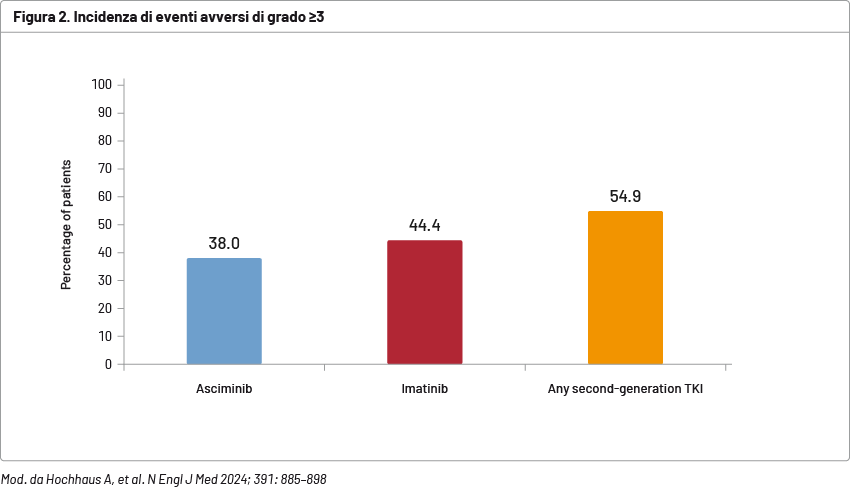
Confrontando asciminib con i soli pazienti trattati con TKI di seconda generazione, non si riscontrava una differenza statisticamente significativa nelle percentuali di MMR, con una differenza pari all’8,2% (66% con asciminib vs 57,8% con TKI di seconda generazione, rispettivamente [CI 95%: -5,1–21,5]). Per quanto riguarda la safety, il profilo di sicurezza risultava coerente con gli studi registrativi precedenti, con un minor numero di eventi avversi e interruzioni del trattamento rispetto ai TKI standard. In particolare, gli eventi avversi di grado 3 o superiore e gli eventi che avevano portato all'interruzione del regime del trial erano meno frequenti con asciminib (38 e 4,5%, rispettivamente) rispetto a imatinib (44,4 e 11,1%) e ai TKI di seconda generazione (54,9 e 9,8%) (Figura 2).
Conclusioni
In questo studio, che ha confrontato asciminib con i TKI selezionati dallo sperimentatore e imatinib, asciminib mostrava un’efficacia superiore e un profilo di sicurezza favorevole nei pazienti con LMC in fase cronica di nuova diagnosi.


