Numero speciale di "Impact Factor News” n° 1 - Aprile 2016
Attualmente la decisione del trattamento si basa su un numero limitato di marcatori molecolari e sulla valutazione della risposta valutata su base morfologica.
Ad oggi in presenza di un rischio stimato di recidiva maggiore del 35% viene data indicazione al trapianto allogenico in prima remissione completa. Ci sono dubbi in merito all’indicazione alle procedure trapiantologiche in presenza di citogenetica a rischio standard, riscontrata in circa il 50% dei pazienti giovani. La lesione molecolare più comune in questo subset di pazienti è la mutazione del gene codificante per la nucleofosmina (NPM1).
Partendo dal presupposto che l’identificazione della persistenza di malattia minima residua (MRD) in pazienti altrimenti considerati in remissione attraverso l’utilizzo di markers leucemia-specifici come la mutazione nel gene codificante la nucleofosmina (NPM1), potrebbe migliorare la prognosi, gli Autori hanno correlato il profilo molecolare pre-trattamento e post-trattamento in pazienti in prima linea di trattamento inclusi nel protocollo AML17.
Materiali e metodi
Gli Autori hanno valutato un pannello con 51 geni per determinare il profilo genetico delle cellule leucemiche in 223 campioni ottenuti alla diagnosi e 49 campioni ottenuti alla recidiva. Nei pazienti con mutazioni di NPM1 sono state effettuate valutazioni della MRD mediante real-time PCR quantitativa dopo ogni ciclo di chemioterapia e successivamente ogni 3 mesi per 2 anni (346 pazienti con NPM1-mutato - 2569 campioni analizzati, 902 da midollo e 1667 da sangue periferico).
Risultati
Nel gruppo dei 346 pazienti NPM1-mutati, gli autori hanno identificato 150 sottogruppi distinti in base al profilo molecolare, a conferma dell’elevata eterogeneità molecolare con conseguente preclusione della possibilità di un’ulteriore predizione dell’outcome alla diagnosi.
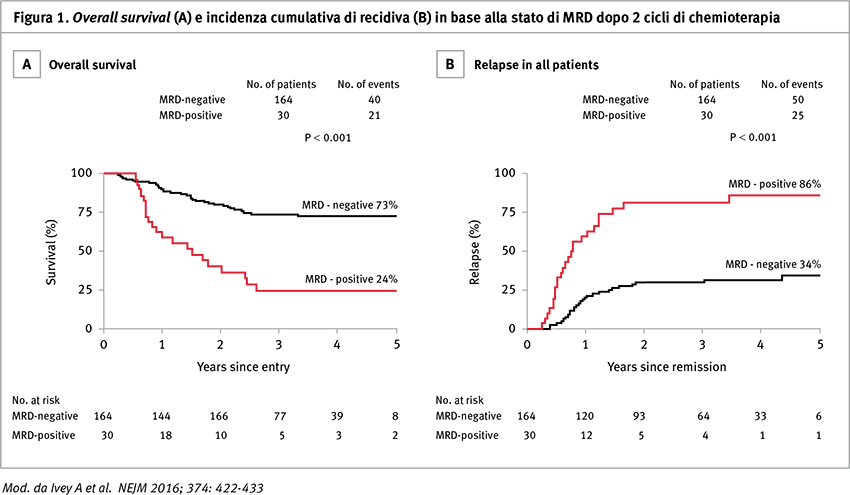
La valutazione della MRD ha dato maggiori informazioni: i pazienti MRD negativi dopo due cicli di chemioterapia avevano un rischio di recidiva inferiore e un miglior tasso di sopravvivenza, anche in presenza di alterazioni molecolari a prognosi sfavorevole quali FLT3-ITD e DNMT3A. Al contrario, i pazienti MRD positivi dopo due cicli avevano una prognosi sfavorevole, indipendentemente dalla co-espressione di mutazioni a cattiva prognosi.
La persistenza di trascritto di NPM1-mutato nel sangue è stata riscontrata nel 15% dei pazienti dopo il secondo ciclo di chemioterapia e si associava a un maggior rischio di recidiva a 3 anni (82 vs 30% HR 4,80; 95% CI, 2,95–7,8; p <0,001) e a una minore sopravvivenza (24 vs 75%; HR per decesso 4,38; 95% CI, 2,57–7,47; p <0,001) rispetto ai pazienti con negativizzazione del trascritto allo stesso timepoint.
La presenza di malattia minima residua era l’unico fattore indipendente predittivo di decesso nell’analisi multivariata (HR 4,84; 95% CI, 2,57–9,15; p <0,001).
I risultati sono stati validati in una coorte indipendente di 91 pazienti NPM1-mutati analizzati prospetticamente.
Nei 243 pazienti sottoposti a monitoraggio periodico di NPM1 dopo il completamento dei cicli di consolidamento, l’incremento dei livelli di trascritto di NPM1-mutato era predittivo di recidiva in 53 pazienti in remissione morfologica completa (incremento mediano 0,7 log10 mese; range, 0,3–2).
Conclusioni
La persistenza di malattia minima residua valutata mediante determinazione quantitativa della mutazione di NPM1 fornisce una valutazione prognostica accurata e indipendente rispetto ad altri fattori di rischio, e rende potenzialmente possibile l’attuazione di strategie terapeutiche di consolidamento precoce adattate al rischio.


