Numero speciale di "Impact Factor News” n° 1 - Aprile 2017
Background
Le mutazioni genetiche guidano la patogenesi delle sindromi mielodisplastiche (MDS) e ne determinano al fenotipo clinico. Il trapianto allogenico è l’unica strategia curativa disponibile per i pazienti affetti da MDS, ma ad oggi, resta una procedura gravata da rischio di mortalità per complicanze o recidiva. Su NEJM sono riportati i risultati di un ampio studio condotto per valutare il significato predittivo delle mutazioni somatiche identificate in campioni di sangue di pazienti con MDS nel predire l’efficacia del trapianto.
Metodi
Lindsey e colleghi hanno eseguito l’analisi mutazionale in campioni di sangue ottenuti prima della somministrazione del regime di condizionamento del trapianto in 1514 pazienti affetti da MSD di ogni età raccolti dal Center for International Blood and Marrow Transplant Research Repository tra il 2005 e il 2014 in 130 centri che effettuano trapianti di midollo nelle MDS.
Nell’analisi sono stati sequenziati 129 geni selezionati in base al loro coinvolgimento, noto o presupposto, nella patogenesi dei tumori mieloidi o delle sindromi da insufficienza midollare ereditaria o acquisita.
Gli autori hanno valutato l’associazione tra il profilo mutazionale e gli outcomes del trapianto (sopravvivenza globale, recidiva e morte per cause diverse dalla recidiva).
Risultati
L’analisi dei dati ha dimostrato che la mutazione del gene TP53 è la singola alterazione con maggior significato predittivo. Questa mutazione è stata riscontrata nel 19% dei pazienti. La sua presenza si associa a una minor sopravvivenza globale e un minor tempo alla recidiva, l’impatto prognostico di p53 si è mantenuto invariato dopo correzione per gli altri fattori prognostici clinici (l’età, il performance status, il regime di condizionamento con un p <0,001).
Tra i pazienti di età superiore a 40 anni TP53 negativi, la presenza di mutazioni della via di RAS ha comportato una minor sopravvivenza per aumentato rischio di recidiva (p = 0,004), nei pazienti con mutazioni di JAK2 l’aumentato rischio di morte è stato determinato da fattori indipendenti dalla ricaduta (p = 0,001).
L’impatto prognostico negativo di TP53 e l’aumento del rischio di mortalità correlato alle mutazioni di JAK2 sono indipendenti dal tipo di condizionamento somministrato (a intensità ridotta (RIC) o mieloablativo). In presenza di mutazioni del pathway di RAS si è osservato un aumentato rischio di recidiva solo in caso di condizionamento a intensità ridotta (p <0,001) suggerendo la necessità di far ricorso a un condizionamento mieloablativo in questo sottogruppo di pazienti.
Sorprendentemente nel 4% dei giovani adulti è stata riscontrata la mutazione eterozigote del gene associato alla sindrome di Shwachman–Diamond, in questi casi si evidenziava la mutazione acquisita di TP53 determinante una prognosi infausta.
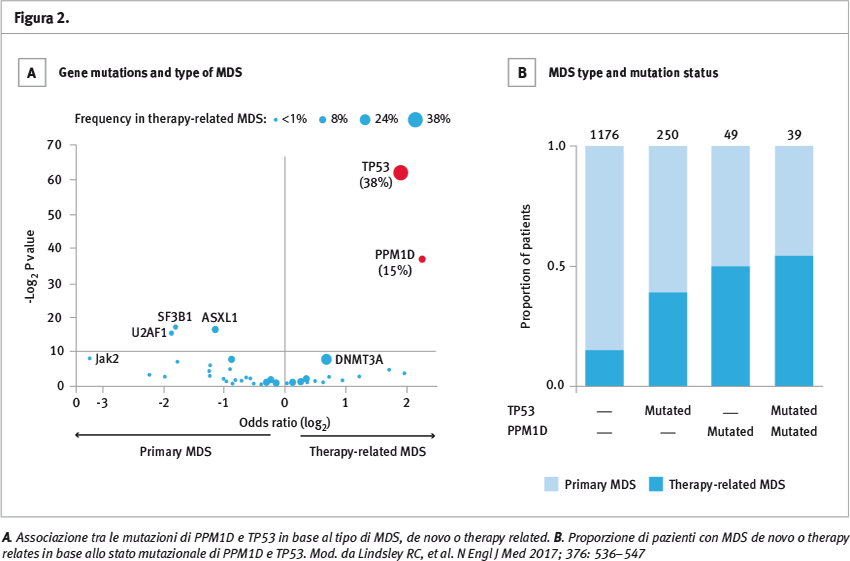
Nelle mielodisplasie secondarie a chemio o radioterapia si è osservata una maggiore incidenza di mutazioni del gene PPM1D, regolatore di Tp53, rispetto alle forme primitive (incidenza 15 vs 3%, p <0,001).
Conclusioni
La profilazione genetica permette l’identificazione di sottogruppi di pazienti con diversa possibilità di beneficio dal trapianto allogenico e potrebbe aiutare a perfezionare i regimi di condizionamento e le strategie di prevenzione delle ricadute.