Numero speciale di "Impact Factor News” n° 1 - Aprile 2018
Introduzione
Sono stati pubblicati i risultati dello studio HD18 condotto dal Gruppo cooperativo Tedesco GHSH e disegnato per valutare la possibilità di modulare il trattamento del linfoma di Hodgkin in base alla risposta PET dopo 2 cicli di eBEACOPP (bleomicina, etoposide, doxorubicina, ciclofosfamide, vincristina, procarbazina e prednisone) (PET2), incrementando il trattamento nei pazienti PET2 positivi e riducendolo in caso di negatività.
La eBEACOPP è un regime polichemioterapico molto efficace negli Hodgkin in stadio avanzato ma gravato da un importante carico di tossicità, pertanto l’identificazione di pazienti che possano essere curati con una minor intensità di trattamento rappresenterebbe un’importante ottimizzazione del percorso di cura.
Pazienti e metodi
Lo studio randomizzato, di fase III a gruppi paralleli ha arruolato pazienti di età compresa tra 18 e 60 anni con linfoma di Hodgkin non pretrattato afferenti a 301 Centri Europei (Germania, Svizzera, Austria, Paesi Bassi e Repubblica Ceca). Dopo la revisione centralizzata della PET2 i pazienti venivano randomizzati con rapporto 1:1 in uno dei due gruppi di trattamento paralleli assegnati in base all’esito dell’esame stesso. I pazienti con PET2 positiva erano randomizzati a ricevere 6 ulteriori cicli eBEACOPP standard (eBEACOPP x 8) o 6 cicli eBEACOPP con aggiunta di rituximab nel gruppo sperimentale (R-eBEACOPP x 8). Analogamente i pazienti PET2 negativi potevano ricevere 6 ulteriori cicli eBEACOPP standard (eBEACOPP x 8) o 2 soli cicli aggiuntivi di eBEACOPP se randomizzati nel braccio sperimentale (eBEACOPP x 4).
Nel giugno 2011, un emendamento del protocollo ha ridotto la terapia standard a 6 cicli eBEACOPP complessivi: da quel momento in poi i pazienti PET2 non sono stati ulteriormente randomizzati e hanno ricevuto tutti eBEACOPP x 6, i pazienti PET2 negativi hanno continuato a essere randomizzati a ricevere eBEACOPP x 6 (gruppo standard) o x 4 cicli (gruppo sperimentale). La randomizzazione era centralizzata e utilizzava il metodo della minimizzazione in base al centro, l’età (>45 o ≤45 anni), lo stadio (IIB, IIIA verso IIIB IV), il punteggio nello score prognostico internazionale (02 vs 3-7) e il sesso.
eBEACOPP veniva somministrata come riportato in letteratura. Il rituximab era somministrato al dosaggio di 375 mg/m2 (dose massima totale 700 mg). L’obiettivo primario dello studio era dimostrare la superiorità del braccio sperimentale nelle coorti PET2 positive e la non inferiorità nelle coorti PET2 negative in termini di progression-free survival (PFS). La non inferiorità era definita come una differenza assoluta del 6% nella PFS stimata a 5 anni.
L’analisi primaria della coorte PET2 negativa era effettuata per protocollo, tutte le altre analisi in base all’intention to treat. Lo studio è registrato su ClinicalTrials.gov, numero NCT00515554.
Risultati
Tra maggio 2008 e giugno 2014 sono stati randomizzati 2101 pazienti, 137 dei quali non eleggibili prima della randomizzazione e ulteriori 19 non eleggibili dopo la randomizzazione.
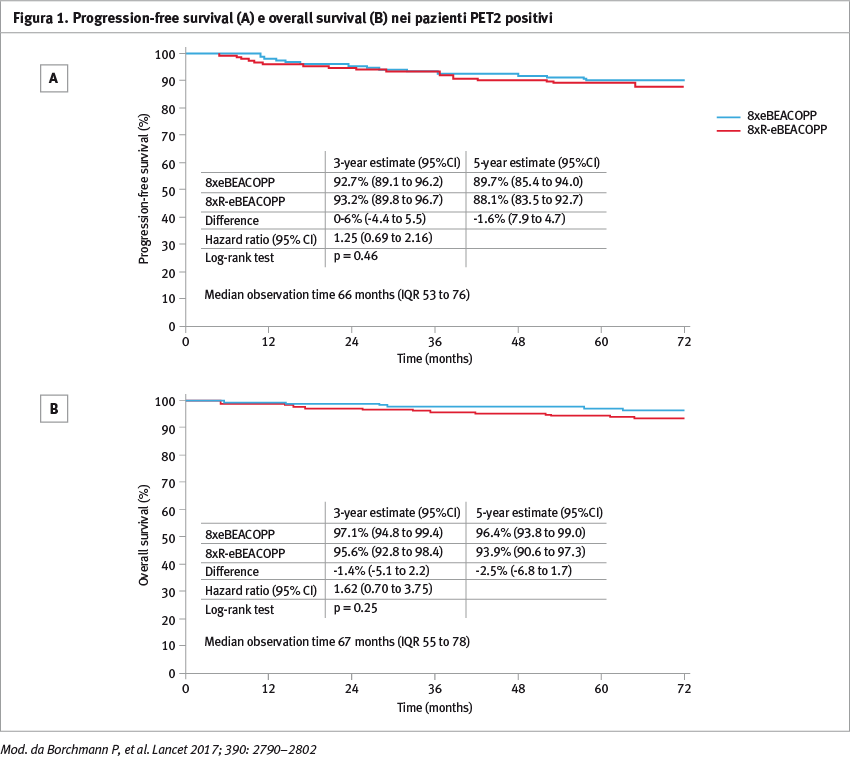
Per quanto riguarda i 434 pazienti PET2 positivi (217 per braccio), la PFS a 5 anni era 89,7% (95% CI 85,4–94,0) nel gruppo eBEACOPP e 88,1% (83,5–92,7) nel gruppo R-eBEACOPP (p=0,46) (Figura 1).
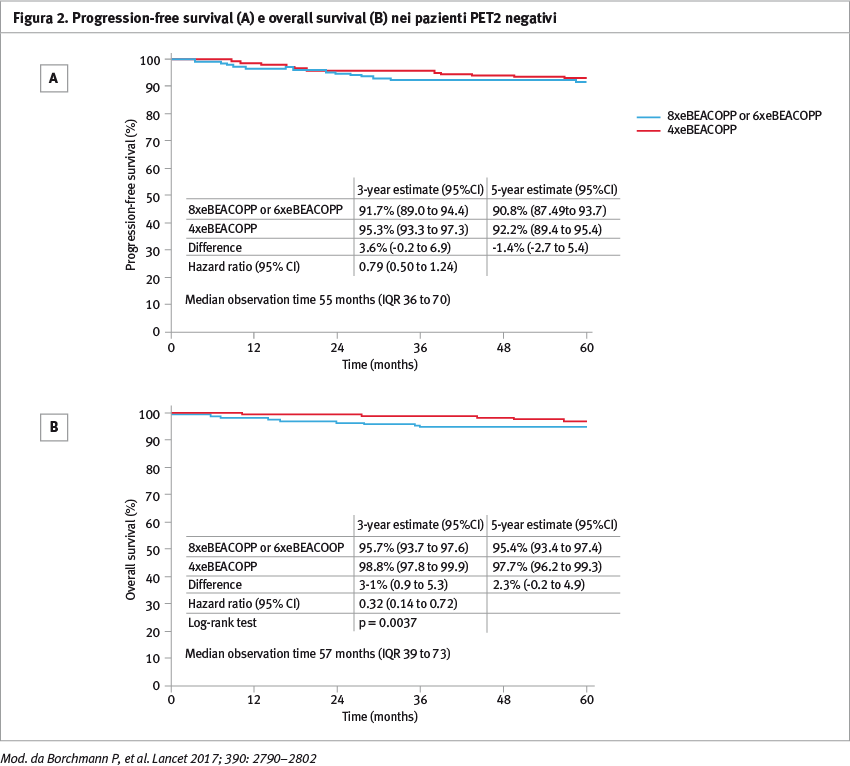
Nei pazienti PET2 negativi trattati nel braccio standard con 8 o 6 cicli eBEACOPP come da emendamento (n=504) o nel braccio sperimentale con 4 cicli eBEACOPP (n=501) la PFS a 5 anni era rispettivamente del 90,8% (95% CI 87,9–93,7) e 92,2% (95% CI 89,4–95,0), (differenza 1,4%, 95% CI 2,7–5,4) (Figura 2).
Per quanto riguarda i pazienti PET2 negativi nel gruppo sperimentale si sono verificati meno eventi avversi, sia per quanto riguarda le infezioni severe, con 40 eventi (8%) in 498 pazienti del braccio sperimentale vs 75 (15%) in 502 pazienti nel braccio standard, sia in termini di tossicità d’organo con 38 eventi (8%) in 498 pazienti vs 91 (18%) in 502.
Si sono verificati 10 decessi correlati al trattamento: 4 nel gruppo PET2 positivo (1 con eBEACOPP x8 [<1%] e 3 con R-eBEACOPP x8 [1%]) e 6 nel gruppo PET2 negativo tutti nel gruppo standard (1%).
Conclusioni
Gli Autori concludono che l’aggiunta di rituximab non migliora ulteriomente l’outcome nei pazienti PET2 positivi rispetto al trattamento standard con eBEACOPP.
Nei pazienti PET2 negativi è possibile ridurre a 4 il numero di cicli eBEACOPP senza ridurre l’efficacia del trattamento e migliorando la sopravvivenza grazie alla riduzione dei rischi correlati alla chemioterapia. Gli Autori raccomandano l’adozione della strategia di descalation PET2 guidata per i pazienti con linfoma di Hodgkin in stadio avanzato.