Numero speciale di "Impact Factor News” n° 1 - Aprile 2023
Introduzione
La terapia con cellule T con recettore dell’antigene chimerico (CAR-T) anti-CD19 ha rivoluzionato la gestione della leucemia linfoblastica acuta (ALL) pediatrica recidivata/refrattaria; tuttavia, circa la metà dei pazienti presentano una ricaduta entro un anno. Nei pazienti recidivati dopo terapia CAR-T anti-CD19, il trattamento con CAR-T anti-CD22 ha dimostrato di indurre un’alta percentuale di remissione completa, ma ancora con un elevato tasso di recidiva. L’impiego di un trattamento con doppio target CD19/CD22 non ha ottenuto risultati superiori a quelli della terapia con le sole CAR-T anti-CD19, mentre la somministrazione in sequenza di CAR-T dirette contro CD19 e CD22 ha dato risultati promettenti. Partendo da queste evidenze, gli sperimentatori cinesi hanno ipotizzato che la co-somministrazione di cellule CAR-T anti-CD19 e anti-CD22 potesse prevenire lo sviluppo di resistenze ai trattamenti e migliorare l'efficacia della terapia. Questa strategia è stata testata in uno studio di fase II riportato sul Journal of Clinical Oncology in pazienti pediatrici con ALL a cellule B (ALL-B) recidivata/refrattaria, con malattia ematologica e/o extramidollare.
Metodi
Lo studio di fase II ha arruolato 225 pazienti valutabili di età inferiore o uguale a 20 anni. Gli endpoints primari dello studio includevano la dose raccomandata di cellule CAR-T anti-CD19 e anti-CD22 somministrabili in contemporanea, gli eventi avversi correlati all'infusione, il tasso di remissione completa al giorno 28 dall'infusione e la sopravvivenza globale (OS) a 12 mesi con o senza trapianto di consolidamento. Dopo una prima fase di run-in di valutazione della sicurezza, un’analisi ad interim sui primi 30 pazienti trattati (27 alla dose raccomandata) ha dimostrato che la somministrazione in sincrono delle CAR-T è stata sicura ed efficace, consentendo l’arruolamento degli altri pazienti con malattia ematologica recidivata/refrattaria (n=194) trattati con una dose mediana di 5,6×106 cellule CAR-T/kg e di pazienti in recidiva extramidollare (n=31) trattati con una dose mediana di 7,0×106 cellule CAR-T/kg.
Risultati
Nel 99,0% dei 194 pazienti trattati affetti da malattia recidivata/ refrattaria è stata ottenuta la remissione completa, con negativizzazione della malattia residua minima. La sopravvivenza libera da eventi (EFS) a 12 mesi è stata del 73,5% (confidence interval, CI 95%: 67,3–80,3). La recidiva si è verificata in 43 pazienti (24 recidive CD19+/CD22+, 16 recidive CD19–/CD22+, 1 recidiva CD19–/CD22– e 2 recidive sconosciute). Il consolidamento con trapianto e la persistenza di aplasia delle cellule B a sei mesi sono risultate correlate con una prognosi migliore: l'EFS a 12 mesi nei 78 pazienti consolidati con trapianto è stata dell'85,0% verso un EFS del 69,2% nei 116 pazienti non trapiantati (p=0,03), mentre tutti i 25 pazienti con aplasia persistente delle cellule B sono rimasti in remissione a 12 mesi (Figura 1).
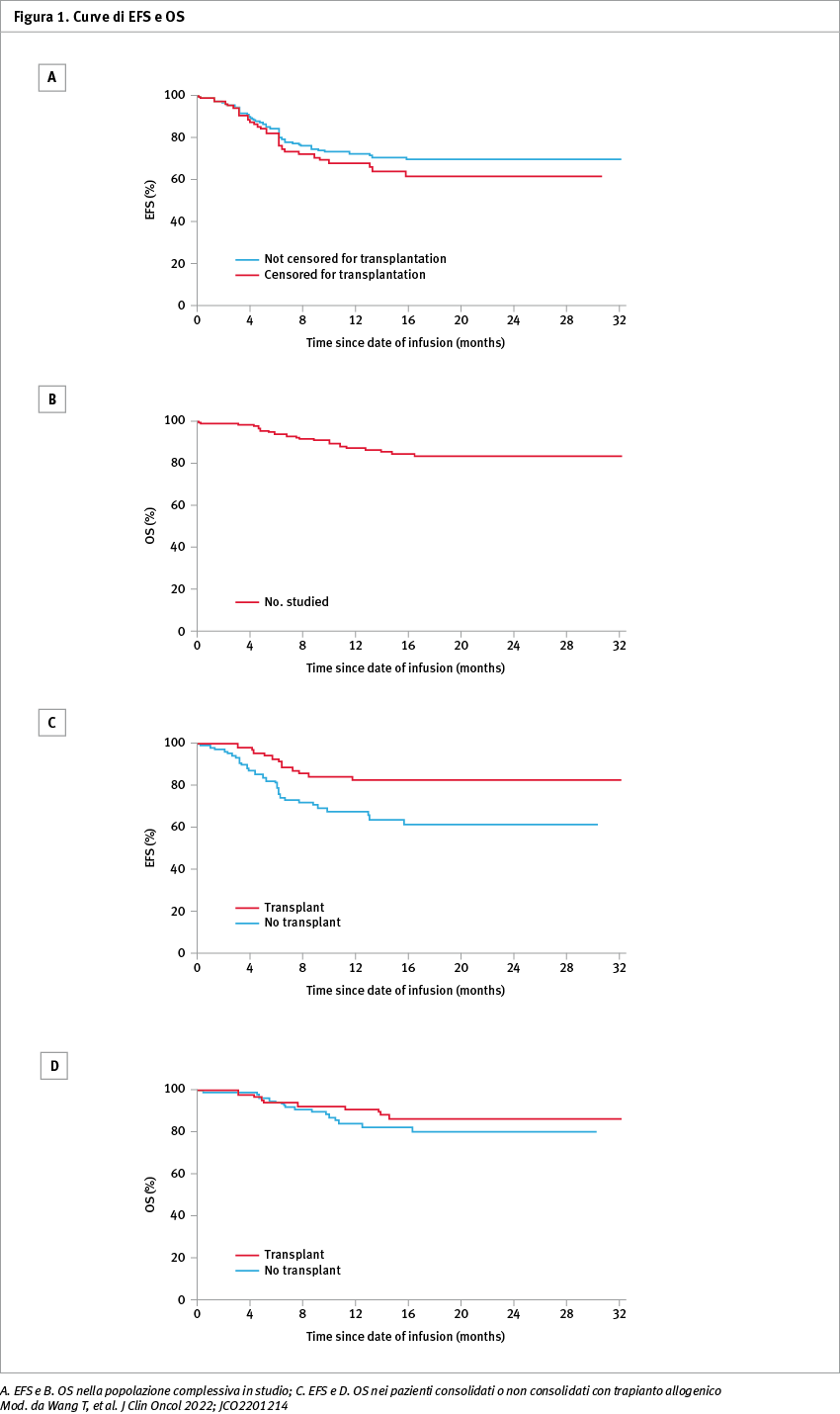
L'EFS a 12 mesi per i 20 pazienti con recidiva testicolare isolata è stata del 95,0%, quella dei 10 pazienti con recidiva isolata del sistema nervoso centrale è stata del 68,6%. In 198 pazienti (88,0%) si è verificata una sindrome da rilascio di citochine (CRS). La CRS è stata di grado ≥3 in 64 pazienti (28,4%), con un decesso. In 47 pazienti (20,9%) è stata riscontrata sindrome da neurotossicità associata a cellule effettrici immunitarie (ICANS), con due decessi correlati.
Conclusioni
Gli autori concludono che la somministrazione concomitante della terapia con CAR-T anti-CD19 e anti-CD22 ha determinato una EFS duratura in bambini con ALL-B recidivata/refrattaria, compresi pazienti con malattia extramidollare. In base a questi dati, nonostante il follow-up limitato per poter determinare l’effettiva durata della risposta, la co-somministrazione di CAR-T anti-CD19 e anti-CD22 potrebbe essere una strategia terapeutica promettente in questo setting di pazienti.


