Numero speciale di "Impact Factor News” n° 4 - Ottobre 2020
Introduzione
Lisocabtagene maraleucel (liso-cel) è un prodotto chimerico a cellule T autologo, dell'antigene diretto contro CD19. In questo studio gli autori hanno voluto valutare l'attività e la sicurezza di liso-cel in pazienti con linfoma a grandi cellule B recidivato-refrattario (RR).
Metodi
Abbiamo condotto uno studio prospettico, di fase I/II, presso 14 centri oncologici negli Stati Uniti. Sono stati arruolati pazienti adulti (di età ≥18 anni) con linfoma a grandi cellule B RR. I sottogruppi istologici ammessi dal protocollo includevano linfoma diffuso a grandi cellule B, linfoma a cellule B di alto grado con riarrangiamenti di MYC e BCL-2, BCL-6 o entrambi (linfoma a double o triple hit), linfoma diffuso a grandi cellule B trasformato da qualsiasi linfoma indolente, linfoma a cellule B primitivo del mediastino e linfoma follicolare di grado 3B. I pazienti sono stati assegnati a uno dei tre livelli di dose target di liso-cel, poiché sono stati testati in sequenza nello studio (50×10⁶ cellule CAR+ T [una o due dosi], 100×10⁶ cellule CAR+ T e 150×10⁶ cellule CAR+ T), che sono stati somministrati come infusione sequenziale di due componenti (cellule CD8+ e CD4+ CAR+ T) a dosi target uguali. Gli endpoint primari erano gli eventi avversi, le tossicità dose-limitanti e il tasso di risposta obiettiva (valutato secondo i criteri di Lugano 2014); gli endpoint sono stati valutati da un comitato di revisione indipendente nel set di valutazione dell'efficacia (comprendente tutti i pazienti che avevano confermato la malattia PET-positiva e avevano ricevuto almeno una dose di liso-cel). Questo studio è registrato con ClinicalTrials.gov, NCT02631044. Finanziamento di Juno Therapeutics, una società Bristol-Myers Squibb.
Risultati
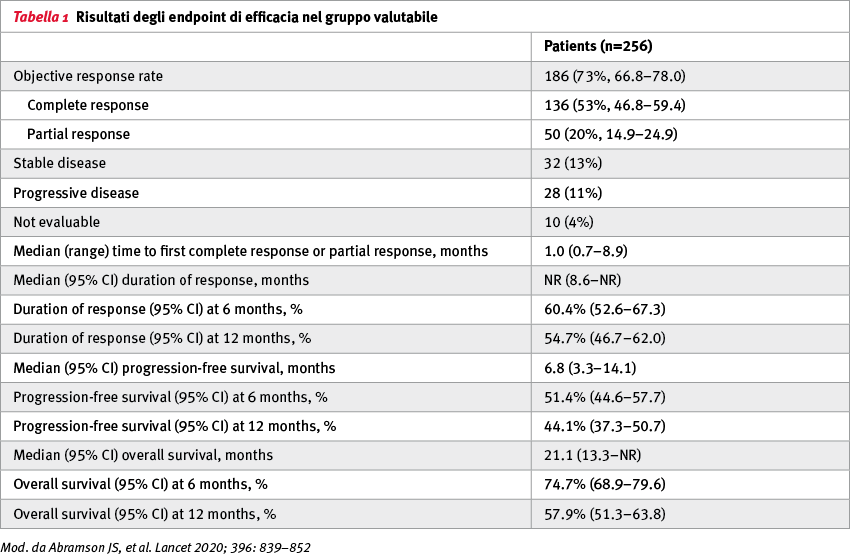
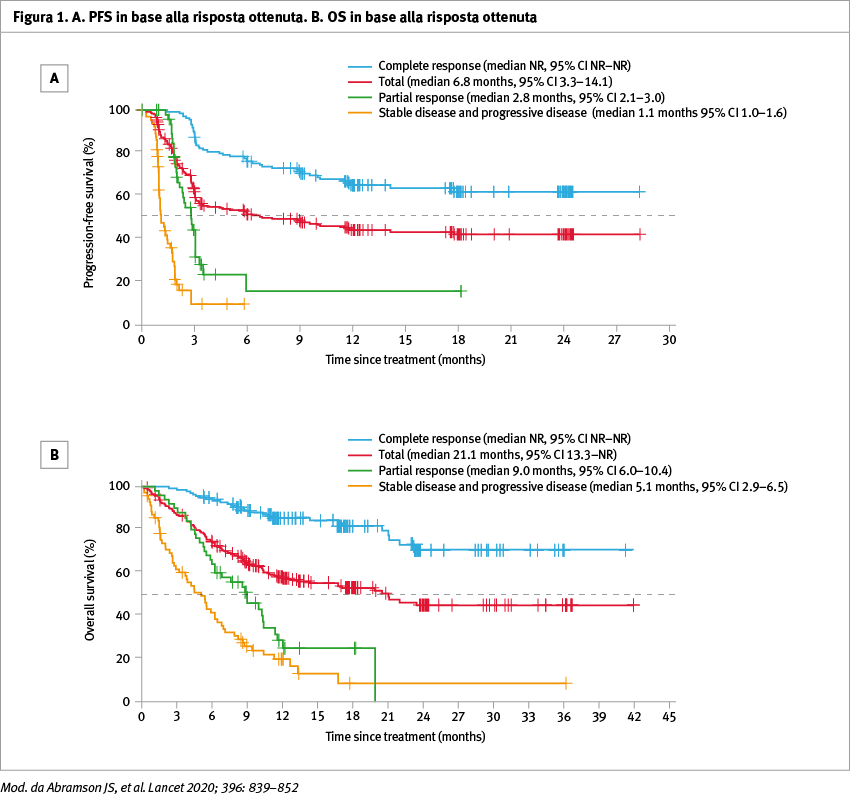
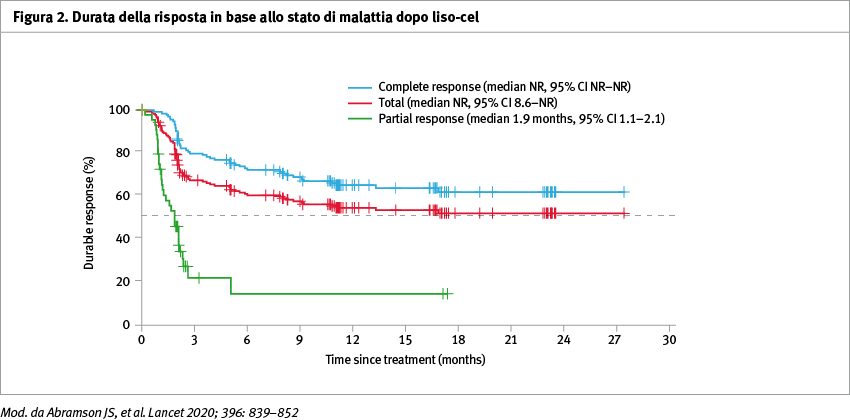
Tra l'11 gennaio 2016 e il 5 luglio 2019 344 pazienti sono stati sottoposti a leucaferesi per la produzione di cellule CAR+ T (liso-cel); di questi, 269 pazienti hanno ricevuto almeno una dose di liso-cel. I pazienti avevano ricevuto una mediana di tre precedenti linee di trattamento sistemico (range 1–8), con 260 pazienti (97%) che avevano avuto almeno due linee. Inoltre, 112 pazienti (42%) avevano un'età pari o superiore a 65 anni, 181 (67%) avevano una malattia refrattaria alla chemioterapia e 7 (3%) avevano un coinvolgimento secondario del sistema nervoso centrale. Il follow-up mediano per l’overall survival (OS) per tutti i 344 pazienti con leucaferesi è stato di 18,8 mesi (95% CI 15,0–19,3) (Figura 1). La sicurezza e l'attività complessive di liso-cel non differivano in base al livello di dose. La dose target raccomandata era di 100×10⁶ cellule CAR+ T (50×10⁶ CD8+ e 50×10⁶ CD4+ cellule CAR+ T). Dei 256 pazienti inclusi nel set valutabile per l'efficacia, una risposta obiettiva è stata raggiunta da 186 (73%, 95% CI 66,8–78,0) e una risposta completa da 136 (53%, 95% CI 46,8–59,4) (Tabella 1, Figura 2). Gli eventi avversi di grado >3 più comuni sono stati: neutropenia in 161 pazienti (60%), anemia in 101 (37%) e trombocitopenia in 72 (27%). La sindrome da rilascio di citochine e gli eventi neurologici si sono verificati rispettivamente in 113 (42%) e 80 (30%) pazienti. La sindrome da rilascio di citochine di grado >3 e gli eventi neurologici si sono verificati rispettivamente in 6 (2%) e 27 (10%) pazienti. Nove pazienti (6%) hanno sviluppato una tossicità dose-limitante, incluso un paziente che è morto.
Conclusioni
Gli autori concludono che l'uso di liso-cel determina un alto tasso di risposte oggettive, con una bassa incidenza di sindrome da rilascio di citochine di grado ≥3 ed eventi neurologici in pazienti con linfoma a grandi cellule B RR, compresi quelli con diversi sottotipi istologici, tra cui quelli con fattori prognostici ad alto rischio. Liso-cel è in fase di ulteriore valutazione alla prima recidiva nei linfomi a grandi cellule B e come trattamento per altri linfomi a cellule B RR.


