Numero speciale di "Impact Factor News” n° 1 - Aprile 2015
Background
Ruxolitinib, un inibitore selettivo di JAK1 e JAK2, è stato sviluppato in seguito alla scoperta delle mutazioni di JAK2 nelle sindromi mieloproliferative Ph-. Il farmaco ha effetti antiproliferativi e proapoptotici, attraverso l’attenuazione dei segnali citochinici conseguenti all’inibizione di JAK1 e JAK2 (wild-type o mutato). Ruxolitinb agisce quindi indipendentemente dallo stato mutazionale di JAK2 ed è attualmente approvato per il trattamento delle mielofibrosi. In uno studio di fase II, è stata osservata l’attività di ruxolitinib nella policitemia vera (PV) intollerante o refrattaria ad oncocarbide. Su questi dati è stato disegnato lo studio registrativo di fase III RESPONSE, i cui risultati sono stati pubblicati da Vannucchi et al. sul NEJM.
Metodi
Lo studio di fase III ha randomizzato 222 pazienti resistenti o intolleranti a idrossiurea (HU), secondo i criteri ELN (European LeukemiaNet) (Barosi G, et al. Br J Haematol 2010; 148: 961–963), a ricevere ruxolitinib alla dose iniziale di 10 mg x 2/die) verso la miglior terapia standard disponibile a giudizio del curante, con rapporto 1:1.
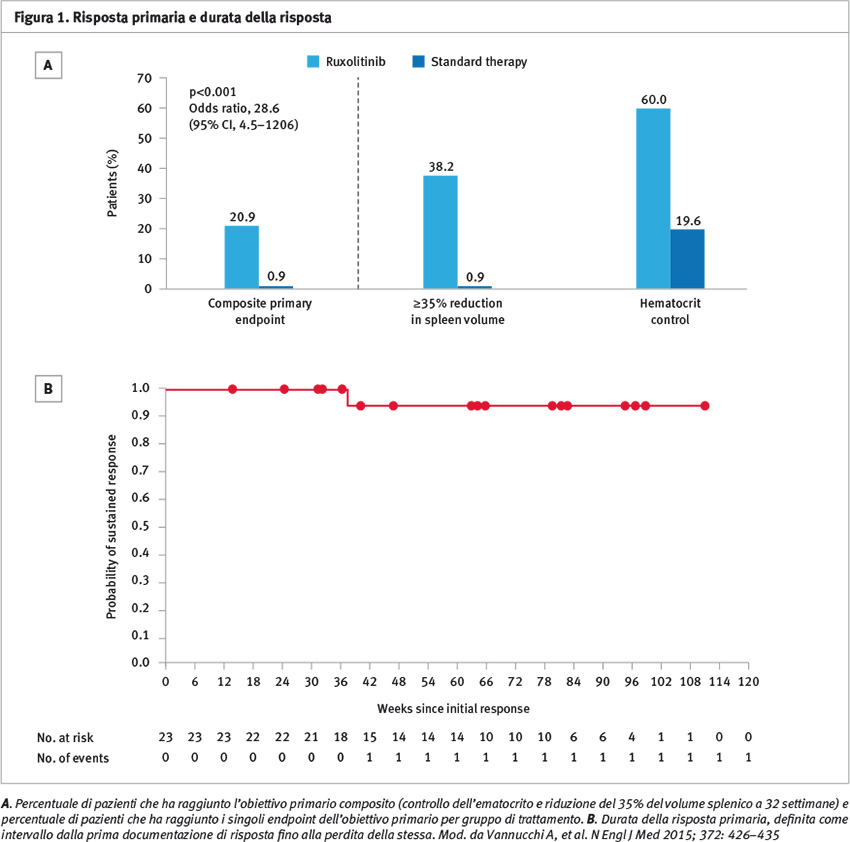
L’obiettivo primario dello studio era considerato raggiunto se i pazienti ottenevano sia il controllo dell’ematocrito (ematocrito <45% senza necessità di salassoterapia), sia la riduzione del 35% del volume splenico (valutato con metodica di imaging TAC o RMN) nelle 32 settimane successive all’attivazione del trattamento.
Endpoint secondari dello studio erano il controllo dei sintomi correlati alla malattia (Myeloproliferative Neoplasm Symptom Assessment Form - MPN-SAF e QLQ-C30), la durata della risposta e la sicurezza.
Risultati
L’endpoint primario composito dello studio è stato raggiunto dal 21% dei pazienti nel braccio ruxolitinib e dall’1% dei pazienti trattati con terapia standard (p <0,001).
Il 77,3% dei pazienti nel gruppo ruxolitinib raggiungeva almeno uno dei due obiettivi individuali dell’endpoint primario composito.
Il controllo dell’ematocrito è stato ottenuto nel 60% dei pazienti nel braccio sperimentale e nel 20% dei pazienti nel braccio di controllo, mentre la riduzione del volume splenico si osservava rispettivamente nel 38% e nell’1% dei pazienti nei due gruppi (Figura 1).
Analogamente si verificava una riduzione del carico sintomatologico >50% nel 49% dei pazienti con ruxolitinib e solo nel 5% dei pazienti con terapia standard.
Il tasso di remissione ematologica completa era del 24% con ruxolitinib e del 9% con terapia standard (p=0,003). Il tasso di risposta a ruxolitinib, suddividendo i pazienti tra resistenti e intolleranti a HU, era simile (19,6 vs 22%).
Per quanto riguarda la tossicità, il 2% dei pazienti nel braccio sperimentale ha manifestato anemia e il 5% piastrinopenia di grado 3-4 rispetto allo 0 e 4% del gruppo trattato con terapia standard.
La riattivazione dell’Herpes Zoster si è verificata nel 6,4% dei pazienti che ha ricevuto ruxolitinib contro lo 0% del gruppo di controllo.
Nel periodo di studio sono stati registrati 7 eventi tromboembolici, 1 caso nel gruppo ruxolitinib e 6 nei pazienti con terapia standard.
Conclusioni
Nei pazienti con risposta inadeguata o tossicità severa a HU, ruxolitinib si è mostrato efficace e superiore alla terapia standard nel determinare la riduzione dell’ematocrito e del volume splenico e un maggior controllo dei sintomi correlati alla malattia.