Numero speciale di "Impact Factor News” n° 1 - Aprile 2015
Background
Lenalidomide associata a desametasone rappresenta il trattamento di riferimento per i pazienti con mieloma multiplo recidivato.
La combinazione di carfilzomib, inibitore del proteosoma di nuova generazione, con lenalidomide e desametasone, nel contesto di studi di fase I e II, ha dimostrato di essere uno schema efficace in questo setting di pazienti.
Gli Autori hanno quindi voluto saggiare la reale efficacia di questo schema ponendolo a confronto con lo standard nel contesto di uno studio prospettico randomizzato.
Metodi
In questo studio 792 pazienti con mieloma multiplo recidivato sono stati randomizzati a ricevere carfilzomib, lenalidomide e desametasone (gruppo carfilzomib) o lenalidomide e desametasone (gruppo controllo).
Carfilzomib è stato somministrato con infusione di 10 minuti nei giorni 1, 2, 8, 9, 15, e 16 (partendo alla dose di 20 mg/m2 nei giorni 1 e 2 del ciclo 1; indi alla dose target di 27 mg/m2 nei cicli successivi) dal primo al dodicesimo ciclo. Successivamente nei giorni 1, 2, 15, e 16 dal 13 fino al 18 compreso; al termine del ciclo 18 carfilzomib veniva sospeso.
Lenalidomide (alla dose standard di 25 mg) è stata somministrata dal giorno 1 al giorno 21. Desametasone (alla dose standard di 40 mg) è stato somministrato nei giorni 1, 8, 15, e 22 di ogni ciclo. Al ciclo 1 era inoltre obbligatoria una terapia idroelettrolitica ev (250 to 500 mL), nei cicli successivi il supporto idroelettrolitico era lasciato a discrezione del medico sperimentatore.
I pazienti di entrambi i gruppi ricevevano quindi lenalidomide e desametasone dopo il ciclo 18 fino a progressione di malattia. I pazienti inoltre ricevevano una profilassi antivirale e antimicrobica. Come obiettivo primario dello studio è stata fissata la progressione libera da malattia (PFS). (Lo studio è sponsorizzato da Onyx Pharmaceuticals; è registrato su ClinicalTrials.gov, numero NCT01080391).
Risultati
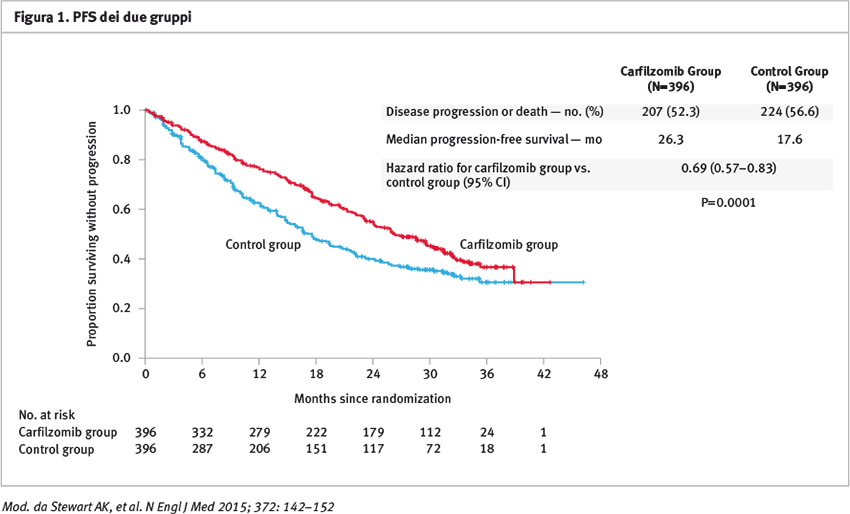
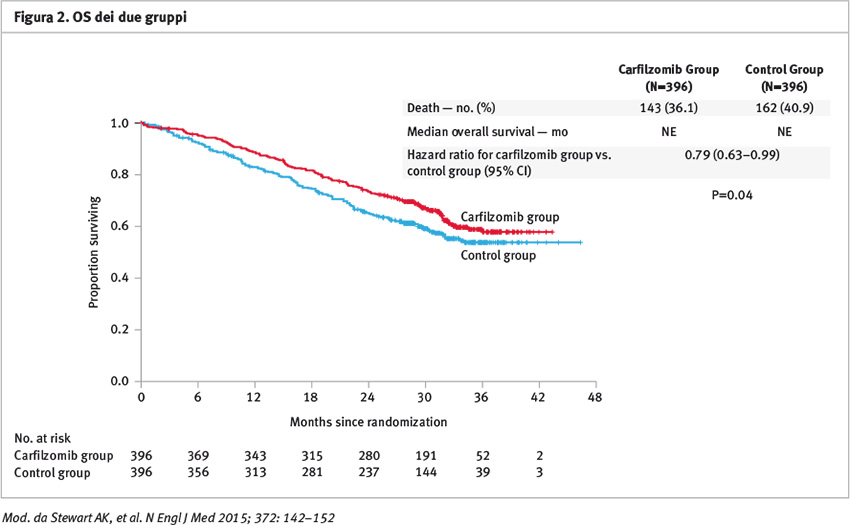
La PFS è stata migliorata significativamente nel gruppo carfilzomib (mediana 26,3 mesi vs 17,6 mesi del gruppo controllo); l’hazard ratio per l’evento progressione o l’evento morte è stata di 0,69; 95% intervallo di confidenza (CI) 0,57 a 0,83; p=0,0001) (Figura 1). La mediana di sopravvivenza globale non è stata raggiunta in nessuno dei due gruppi al momento dell’analisi interim. La sopravvivenza globale (OS) con Kaplan Meier a 24 mesi è stata di 73,3 e 65,0% rispettivamente nel gruppo carfilzomib e in quello controllo (hazard ratio per l’evento morte 0,79; 95% CI 0,63 a 0,99; p=0,04) (Figura 2). Il rate di risposte globali (ossia ottenimento di almeno una risposta parziale) è stato rispettivamente di 87,1% nel gruppo carfilzomib e di 66,7% nel gruppo controllo (p <0,001); in particolare il 31,8% del gruppo carfilzomib e il 9,3% nel gruppo controllo hanno ottenuto una remissione completa o migliore; il 14,1% del gruppo carfilzomib e il 4,3% nel gruppo controllo hanno ottenuto una risposta completa stringente.
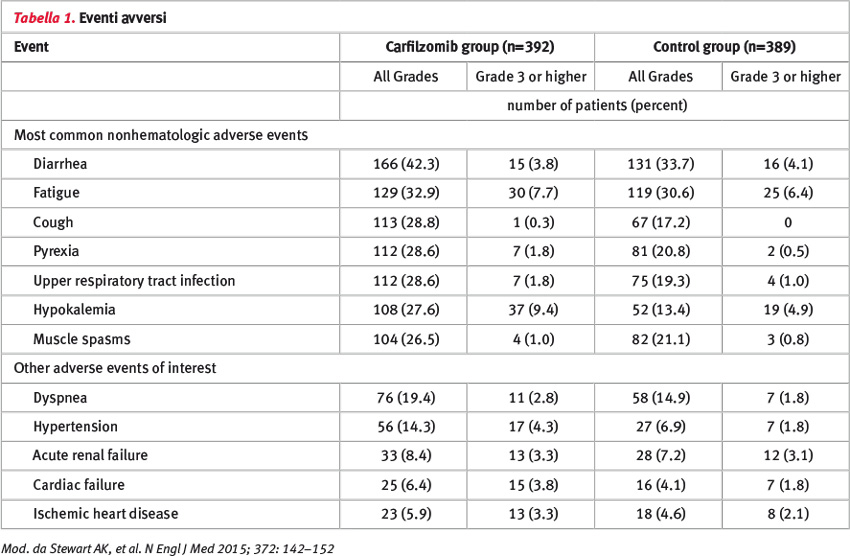
Per quanto riguarda gli eventi avversi, i SAE di grado 3–4 sono stati riportati rispettivamente nell’83,7% dei pazienti del gruppo carfilzomib e nell’80,7% del gruppo controllo; il 15,3% dei pazienti del gruppo carfilzomib e 17,7% dei pazienti del gruppo controllo hanno interrotto la terapia a causa degli eventi avversi (Tabella 1). I pazienti nel gruppo carfilzomib hanno riportato una quality of life superiore.
Conclusioni
Gli Autori concludono che, nei pazienti con mieloma multiplo recidivato, l’aggiunta di carfilzomib allo schema di riferimento lenalidomide e desametasone ha permesso di ottenere una migliore PFS al momento dell’analisi interim con un buon profilo di tollerabilità considerando i rischi e benefici del trattamento di triplice combinazione.