Numero speciale di "Impact Factor News” n° 1 - Aprile 2019
Introduzione
Axicabtagene ciloleucel è una terapia autologa anti-CD19 con recettore antigenico chimerico delle cellule T (CAR T-cell). Nella precedente analisi dei dati dello studio di registrazione di ZUMA-1, con una mediana di follow-up di 15,4 mesi (intervallo: 13,7–17,3), 89 di 108 pazienti (82%) con linfoma aggressivo diffuso a grandi cellule B refrattari, trattati con axicabtagene ciloleucel hanno ottenuto una risposta oggettiva, 63 pazienti (58%) hanno ottenuto una remissione completa. In questo lavoro sono riportati i dati di outcome a lungo termine sull’attività e la sicurezza dello studio ZUMA-1.
Metodi
ZUMA-1 è uno studio multicentrico di fase 2, singolo braccio, coinvolgente 22 centri in USA e Israele. I criteri di inclusione prevedevano pazienti con età ≥18 anni, diagnosi istologicamente confermata di linfoma diffuso a grandi cellule B, primitivo del mediastino, linfoma follicolare trasformato, in accordo con la classificazione WHO 2008; malattia refrattaria o recidivata alle alte dosi; un performance status ECOG tra 0 e 1; che avessero ricevuto in precedenza regimi contenenti anticorpi monoclonali anti-CD20 e antracicline.
I pazienti arruolati hanno ricevuto una dose di axicabtagene ciloleucel al giorno 0 alla dose target di 2 x 106 CAR T-cell per kg di peso corporeo dopo una chemioterapia di condizionamento con fludarabina per via endovenosa (alla dose di 30 mg/m2 di superficie corporea) e ciclofosfamide (alla dose di 500 mg/m2 di superficie corporea) ai giorni −5, −4 e −3.
Gli obiettivi primari dello studio sono stati la tossicità nella parte di fase 1 e le risposte oggettive per lo studio di fase 2; gli obiettivi secondari sono stati la sopravvivenza globale, la sopravvivenza libera da malattia e la durata della risposta. Le analisi di efficacia e di sicurezza erano state pianificate. Nonostante le coorti di registrazione siano chiuse, il trial rimane aperto, e l’arruolamento di nuove coorti di pazienti prosegue con obiettivi alternativi.
Risultati
Tra il 19 maggio 2015 e il 15 settembre 2016, sono stati arruolati 119 pazienti e di questi 108 hanno ricevuto axicabtagene ciloleucel nel contesto delle due parti dello studio di fase 1 e 2.
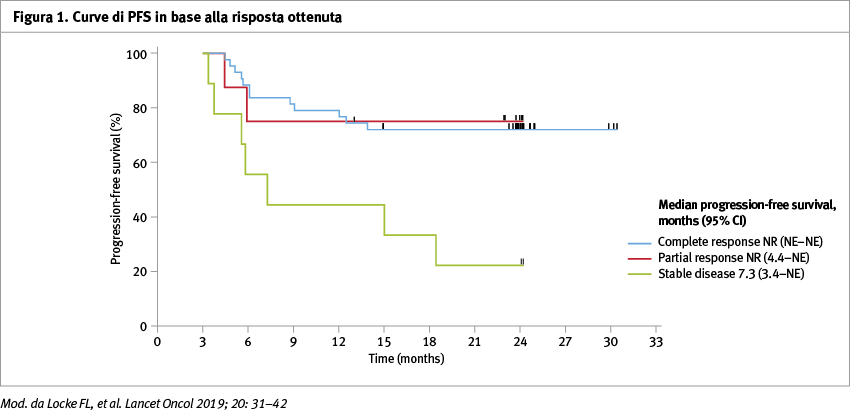
La prima analisi interim è stata eseguita il giorno 11 agosto 2018. Centouno pazienti idonei alla fase 2 dello studio sono stati seguiti con un follow-up mediano di 27,1 mesi (intervallo: 25,7–28,8), di questi 84 (83%) hanno ottenuto una risposta oggettiva, e 59 (58%) hanno ottenuto una remissione completa. La durata mediana di risposta è stata di 11,1 mesi (4,2–non raggiunto).
La mediana di sopravvivenza globale (OS) non è stata raggiunta (12,8–non raggiunto); la mediana di sopravvivenza libera da malattia (PFS) è stata di 5,9 mesi (95% CI, 3,3–15,0) (Figura 1).
Dei 108 pazienti valutabili per la tossicità 52 (48%) hanno presentato eventi avversi di grado severo. La sindrome da rilascio citochinico di grado severo è stata registrata in 12 (11%) pazienti, ed eventi neurologici di grado severo in 35 (32%) pazienti.
Dalla prima analisi avvenuta a un anno, si sono registrati altri eventi avversi severi in 4 pazienti (alterazioni dello stato mentale di grado 3, una sindrome mielodisplastica di grado 4, infezione polmonare di grado 3 e due episodi di batteriemia di grado 3), nessuno dei quali è stato giudicato correlato al trattamento. Nell’analisi precedente sono state riportate due morti correlate al trattamento (dovute a sindrome emofagocitica e ad arresto cardiaco), nel corso di questa seconda analisi, con un follow-up di 24 mesi, non sono state registrate ulteriori morti correlate al trattamento.
Conclusioni
Gli Autori concludono che i dati con due anni di follow-up dello studio ZUMA-1 confermano che axicabtagene ciloleucel è in grado di indurre remissioni durature e mediane di sopravvivenza globale superiori a 24 mesi.
Lo studio ZUMA-1 è registrato su ClinicalTrials.gov, numero NCT02348216.