Introduzione
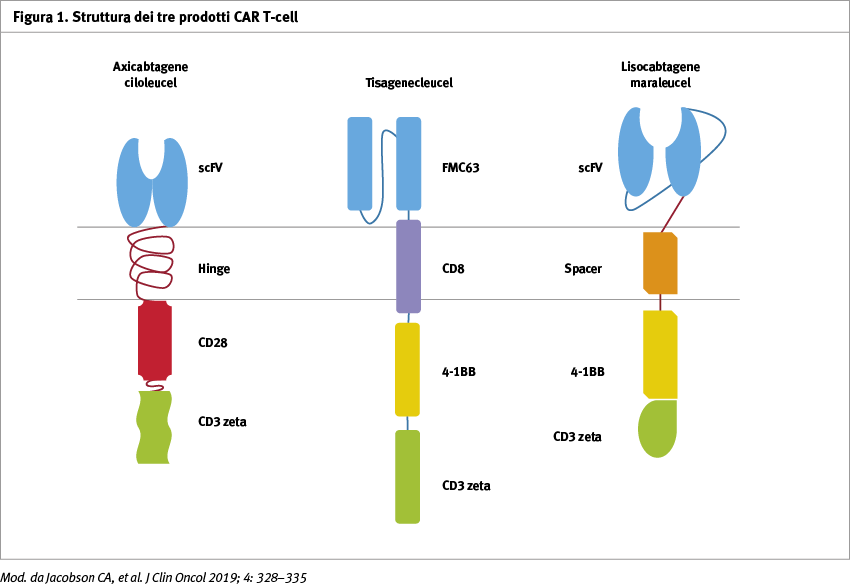
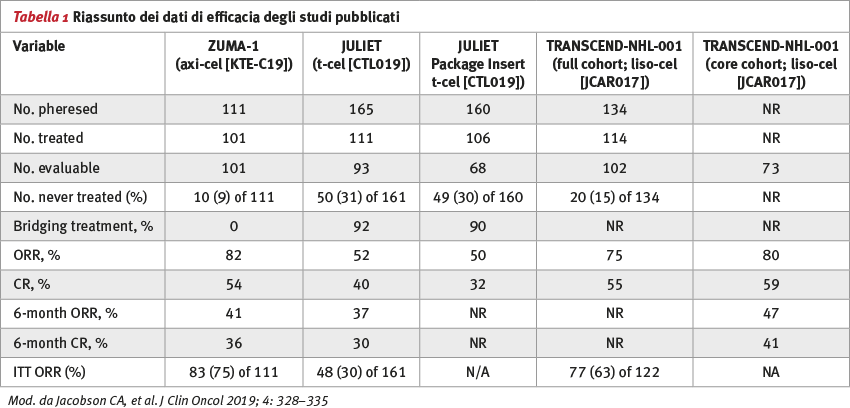
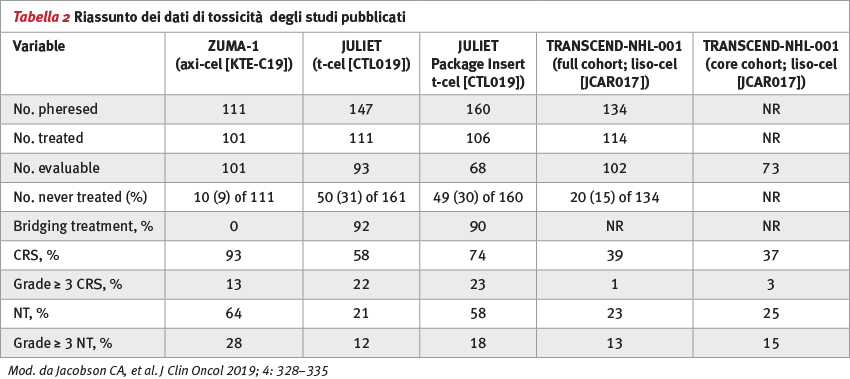
La terapia con linfociti T con recettore chimerico diretto all’antigene CD19 [(CAR) T-cell] ha ottenuto effetti clamorosi in termini di efficacia nel trattamento di pazienti affetti da linfoma aggressivo diffuso a grandi cellule B resistente alla chemioterapia standard. Attualmente vi sono due prodotti approvati dalla US Food and Drug Administration (FDA), disponibili per il trattamento di questi pazienti. Un terzo prodotto verrà approvato nei prossimi mesi (Figura 1). Un quesito si pone ora: c’è un prodotto migliore per il mio paziente o più adatto al mio paziente? Effettivamente la risposta a questa domanda è più complicata di un semplice bilancio tra efficacia e tossicità (Tabelle 1 e 2).
Metodi
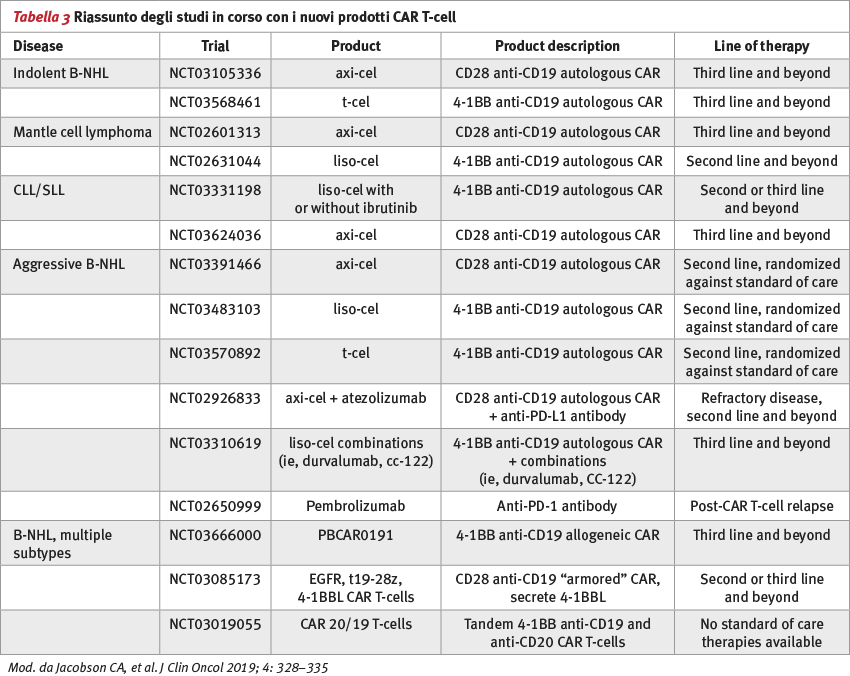
Gli Autori asseriscono che questa revisione evidenzia i potenziali fattori confondenti che coinvolgono i tre prodotti delle CAR T-cell e dei loro studi pilota. Evidenziano inoltre alcune considerazioni sull’affidabilità della produzione e sui costi globali di tali procedure che devono essere soppesati quando si scelga un prodotto piuttosto che un altro. Gli Autori rivedono inoltre le future direzioni nelle quali si muoverà questa strategia di trattamento e i punti di potenziamento, in termini sia di efficacia sia di riduzione delle tossicità (Tabella 3).
Conclusioni
Dal momento che uno studio di fase 3 sarebbe improbabile, un prodotto dovrebbe essere scelto sulla base della valutazione dei risultati dei tre centri che hanno utilizzato ciascuno uno dei tre prodotti. Data la rapida evoluzione di questa procedura, nel momento in cui i dati di questi studi saranno disponibili, è probabile che siano già obsoleti rispetto alle CAR T-cell di nuova generazione.