Numero speciale di "Impact Factor News” n° 1 - Aprile 2019
Introduzione
Nella porpora trombotica trombocitopenica acquisita (TTP), il deficit immuno-mediato di ADAMTS13 (proteasi di clivaggio del fattore von Willebrand), consente un'adesione incontrollata dei multimeri del fattore di von Willebrand (vWF) alle piastrine e provoca microtrombosi, il che si traduce in trombocitopenia severa, anemia emolitica microangiopatica e ischemia tissutale.
Caplacizumab è un nano anticorpo bivalente anti-vWF che inibisce l'interazione tra multimeri di vWF ad alto peso molecolare e le piastrine. Il NEJM ha recentemente pubblicato i risultati dello studio HERCULES che ha testato l’attività di caplacizumab in associazione alla terapia standard nei pazienti affetti da TTP.
Metodi
L’efficacia di caplacizumab è stata valutata in uno studio di fase 3 in doppio cieco. Lo studio ha randomizzato 145 pazienti affetti da TTP a ricevere caplacizumab (10 mg di bolo di carico per via endovenosa, seguiti da 10 mg al giorno per via sottocutanea) o placebo in concomitanza con la plasmaferesi quotidiana e con la terapia immunosoppressiva e per i 30 giorni successivi. L'outcome primario era il tempo di normalizzazione della conta piastrinica, con interruzione della plasmaferesi giornaliera entro i 5 giorni successivi. I principali obiettivi secondari erano l’endpoint composito che valutava l’incidenza di eventi correlata alla TTP (morte, recidiva di TTP o insorgenza di evento tromboembolico durante il periodo di trattamento), la recidiva di TTP in qualsiasi momento durante la sperimentazione, la refrattarietà e la normalizzazione dei marcatori di danno d’organo (lattato deidrogenasi, troponina cardiaca I e creatinina serica).
Risultati
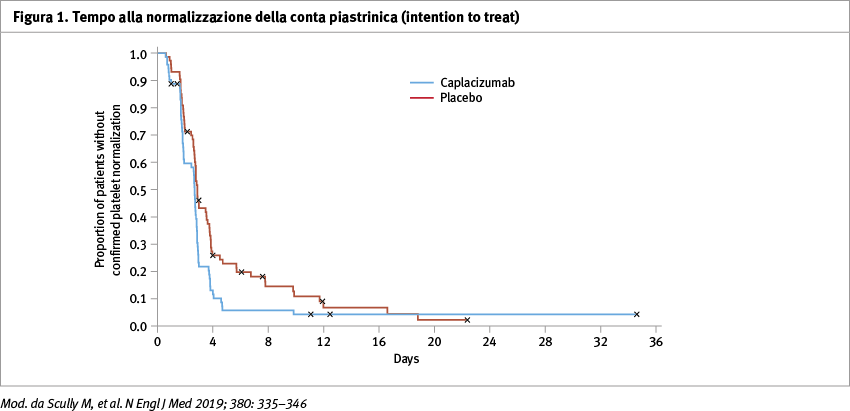
Il tempo mediano di normalizzazione della conta piastrinica era più breve con caplacizumab rispetto al placebo (2,69 giorni [95% CI, 1,89–2,83] vs 2,88 giorni [95% CI, 2,68–3,66], p=0,01) (Figura 1). Ricevere caplacizumab si associava a una probabilità 1,55 volte più alta di ottenere la normalizzazione della conta piastrinica rispetto al placebo. La percentuale di pazienti con un evento incluso nell’endpoint composito era inferiore del 74% con caplacizumab rispetto al placebo (12 vs 49%, p <0,001), analogamente la percentuale di pazienti che hanno avuto una recidiva di TTP in qualsiasi momento durante lo studio è risultata inferiore del 67% con caplacizumab rispetto al placebo (12 vs 38%, p <0,001). Non ci sono stati casi di refrattarietà nel gruppo caplacizumab, diversamente si sono verificati tre casi di refrattarietà al trattamento nel gruppo placebo. Nel gruppo caplacizumab sono stati necessari meno scambi plasmatici con conseguente riduzione della durata del ricovero rispetto al gruppo placebo. Il farmaco ha dimostrato un profilo di sicurezza coerente con quello finora riportato e in linea con il suo meccanismo d'azione: gli eventi avversi registrati con maggior frequenza sono state le emorragie mucocutanee con un’incidenza del 65% nel gruppo caplacizumab e del 48% nel gruppo placebo. Durante il periodo di trattamento, si sono verificati tre decessi nel gruppo placebo. Un paziente nel gruppo caplacizumab è deceduto per ischemia cerebrale dopo la fine del trattamento.
Conclusioni
Nei pazienti con TTP, l’aggiunta di caplacizumab al trattamento standard determina una più rapida normalizzazione della conta piastrinica; una minore incidenza di eventi compositi correlati alla TTP (morte, recidiva o evento tromboembolico durante il trattamento) e una riduzione del tasso di recidive.
La Commissione Europea ha concesso l’autorizzazione all’immissione in commercio di caplacizumab sulla base dei risultati di questo studio e dello studio di fase II TITAN.