Numero speciale di "Impact Factor News” n° 1 - Aprile 2020
Introduzione
Belantamab mafodotin (GSK2857916) è un anticorpo monoclonale anti-IgG1 umanizzato diretto contro l'antigene di maturazione delle cellule B (BCMA) coniugato a monometil auristatina-F, che ha mostrato attività come single agent nello studio di fase 1 DREAMM-1 in pazienti pesantemente pre-trattati con mieloma multiplo (MM) recidivante o refrattario. Lo studio DREAMM-2 ha approfondito ulteriormente la sicurezza e l'attività di belantamab mafodotin. Gli interessanti risultati dello studio sono stati pubblicati da Lonial su Lancet Oncology.
Metodi
Lo studio DREAMM-2 di fase 2, aperto, a due bracci, è stato condotto in 58 centri specializzati nel trattamento del MM. Lo studio ha arruolato pazienti di età ≥18 anni affetti da MM recidivante o refrattario in progressione dopo tre o più linee di terapia e refrattari ai farmaci immunomodulatori e agli inibitori del proteasoma e refrattari o intolleranti (o entrambi) a un anti-CD38 e con un ECOG performance status (PS) 0–2. I pazienti sono stati randomizzati con rapporto 1:1 a ricevere belantamab mafodotin al dosaggio di 2,5 mg/kg o 3,4 mg/kg per via endovenosa ogni tre settimane fino a progressione o a tossicità inaccettabile. I pazienti venivano stratificati in base alle linee di terapia precedentemente ricevute (≤4 vs >4) e alle caratteristiche citogenetiche. La valutazione della sicurezza ha compreso tutti i pazienti che avevano ricevuto almeno una dose di belantamab mafodotin. L'obiettivo primario era la risposta globale nei sottogruppi di trattamento in base all’intention-to-treat, valutato da un comitato di revisione indipendente.
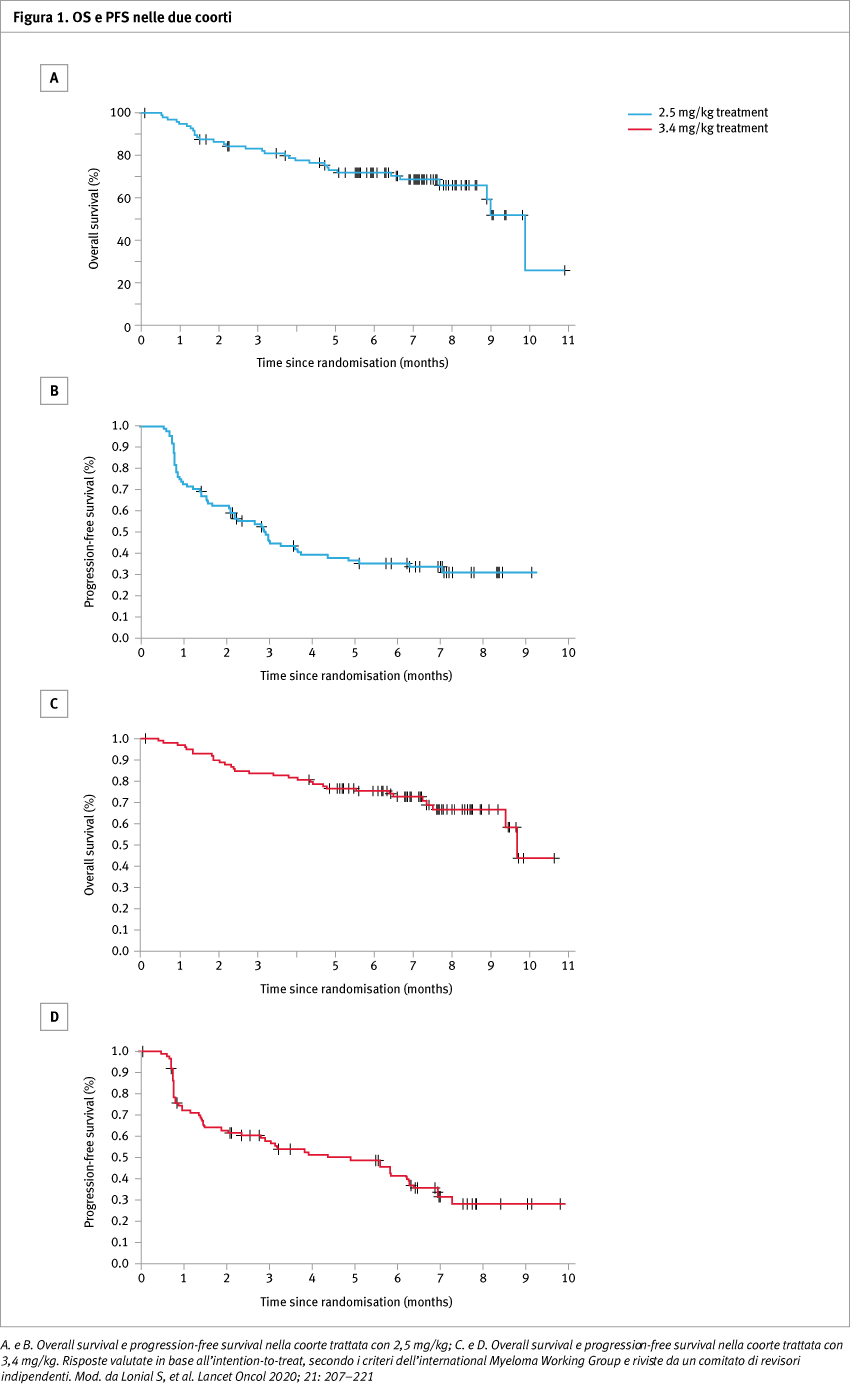
Risultati
Tra giugno 2018 e gennaio 2019, 196 dei 293 pazienti sottoposti a screening sono stati inclusi nella popolazione (97 nella coorte 2,5 mg/kg e 99 nella coorte 3,4 mg/kg). I pazienti avevano precedentemente ricevuto in media 7 linee di terapia (range 3-21). Al 21 giugno 2019 (data limite di analisi dei dati primari), 30 (31%; 97,5% CI 20,8–42,6) su 97 pazienti nella coorte 2,5 mg/kg e 34 (34%; 2,9–46,0) su 99 pazienti nella coorte 3,4 mg/kg avevano ottenuto una risposta globale, comprese rispettivamente il 19% e il 20% di very good partial response. In entrambi i gruppi, tre pazienti hanno ottenuto la remissione completa.
Gli eventi avversi di grado 3-4 più comuni sono stati la cheratopatia (in 26 [27%] su 95 pazienti nella coorte 2,5 mg/kg e 21 [21%] su 99 pazienti nella coorte 3,4 mg/kg), la trombocitopenia (19 [20%] e 33 [33%]) e l’anemia (19 [20%] e 25 [25%]).
Per quanto riguarda gli eventi avversi gravi sono stati riportati in 38 (40%) su 95 pazienti nella coorte 2,5 mg/kg e in 47 (47%) su 99 nella coorte 3,4 mg/kg. In corso di studio si sono verificati due decessi potenzialmente correlati al trattamento (un caso di sepsi nella coorte 2,5 mg/kg e un caso di linfoistiocitosi emofagica nella coorte 3,4 mg/kg).
Conclusioni
Gli Autori concludono che belantamab mafadotin, utilizzato in monoterapia, è attivo nei pazienti con MM recidivante refrattario proponendosi come una valida opzione di trattamento in particolare per i pazienti refrattari gli agenti immunodulatori, agli inibitori del proteosoma e refrattari o intolleranti agli anti-CD38. Il meccanismo d’azione e il profilo di tossicità favorevole lo rendono un candidato interessante per essere testato in studi clinici di combinazione con altri farmaci.