Numero speciale di "Impact Factor News” n° 1 - Aprile 2021
Introduzione
Nel trattamento di prima linea dei pazienti affetti da leucemia linfoblastica acuta (LLA) l'obiettivo primario è ridurre la probabilità di recidiva, che si concretizza nell’obiettivo primario di abbassare la carica tumorale a meno di una cellula tumorale su 10.000 cellule mononucleate di midollo emopoietico.Nella LLA il raggiungimento di una riduzione profonda e sostenuta della malattia minima residua (MRD) è associato a una maggiore possibilità di guarigione. L’obiettivo primario del trattamento è l’ottenimento della remissione molecolare.L’utilizzo di inibitori della tirosin chinasi (TKI) nel trattamento della LLA Philadelphia-positiva (Ph+) ha migliorato l’outcome di questi pazienti. Per questo motivo, negli ultimi 15 anni il gruppo GIMEMA ha adottato una strategia che riguarda il trattamento pre-fase con glucocorticoidi per una settimana, durante il quale tutti i pazienti con nuova diagnosi di LLA vengono valutati centralmente per la presenza o l'assenza del prodotto di fusione genica BCR-ABL1. Pazienti con LLA Ph+ ricevono una fase d’induzione che prevede l'utilizzo di un TKI (più glucocorticoidi) con profilassi del sistema nervoso centrale (SNC) senza chemioterapia sistemica.
Metodi
In questo lavoro gli autori hanno riportato i risultati dello studio di fase II a singolo braccio della terapia di prima linea con dasatinib e glucocorticoidi, seguiti da due cicli di blinatumomab, anticorpo bi-specifico monoclonale anti-CD3 e anti-CD19 in pazienti adulti affetti da LLA Ph+. L’obiettivo primario dello studio era la risposta molecolare sostenuta su campioni di midollo emopoietico a fine trattamento.Le mutazioni ABL1 sono state valutate mediante il sequenziamento di Sanger in pazienti che hanno avuto un aumento della MRD.In 46 pazienti per i quali era disponibile materiale genomico è stato usato il file kit SALSA MLPA Probemix P335 ALL-IKZF1 (MRC Holland) per valutare le delezioni ricorrenti nella diagnostica genomica su DNA. La sperimentazione è stata progettata dal gruppo GIMEMA, in collaborazione con autori accademici. Questo studio è stato registrato su ClinicalTrials.gov: NCT02744768.
Risultati
Sono stati arruolati 63 pazienti, le cui caratteristiche sono riassunte nella Tabella 1. L'analisi di espressione genica ha mostrato che la delezione di IKZF1 era l’aberrazione più frequente (in 25 su 46 pazienti, 54%). La risposta completa è stata osservata nel 98%. Alla fine della terapia di induzione con dasatinib e glucocorticoidi (giorno 85), il 29% dei pazienti ha avuto una risposta molecolare e questa percentuale aumenta al 60% dopo due cicli di blinatumomab; la percentuale di pazienti con una risposta molecolare aumenta nuovamente dopo ulteriori cicli. Dopo due cicli di blinatumomab, non sono state notate differenze statisticamente significative in termini di risposta molecolare tra i pazienti con p190 e quelli con p210 (Tabella 2). A un follow-up mediano di 18 mesi, l’overall survival è stata del 95% e la disease-free survival (DFS) dell’88%; la DFS era inferiore nel sottogruppo di pazienti che avevano delezione di IKZF1 più altre aberrazioni geniche aggiuntive (CDKN2A o CDKN2B, PAX5 o entrambi, cioè IKZF1plus). È stata eseguita un'analisi mutazionale di ABL1 in 15 pazienti che hanno avuto evidenza di un aumento di MRD durante l'induzione e in un paziente che ha avuto una recidiva palese. In sei pazienti tutte queste mutazioni venivano annullate dall’effetto dei due cicli di blinatumomab. L'incidenza cumulativa di recidiva nell'intera popolazione è stata dell'8% (Figura 1). Si sono verificate tre ricadute ematologiche, due recidive isolate al SNC e una nodale. Per quanto riguarda i dati di tossicità, sono stati registrati 21 eventi avversi di grado serio (≥3). Ventiquattro pazienti sono stati avviati a trapianto di cellule staminali di consolidamento con un decesso (4%) correlato al trapianto.


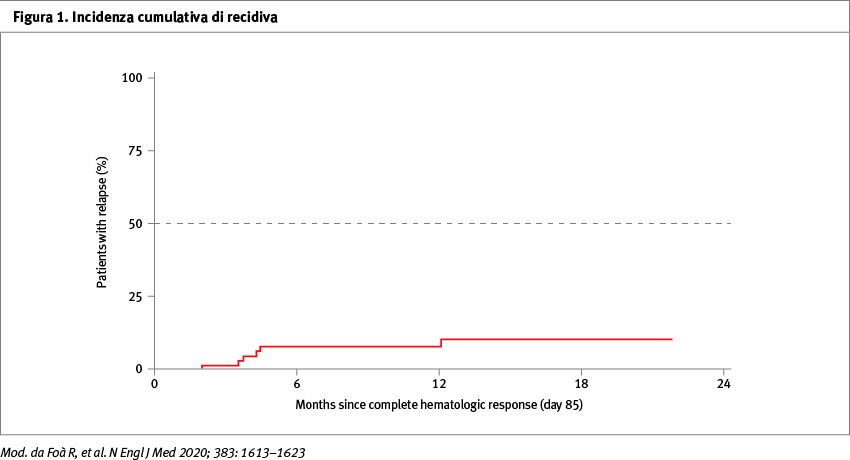
Conclusioni
Gli autori concludono che in questo studio di fase II la strategia chemo-free in prima linea con dasatinib e blinatumomab d’induzione e consolidamento si è dimostrata efficace e in grado di ottenere un’alta percentuale di risposte molecolari con conseguente alta percentuale di relapse-free survival a costo di pochi effetti collaterali di grado severo.


