Numero speciale di "Impact Factor News” n° 1 - Aprile 2022
Introduzione
Lo studio FORTE è stato disegnato per valutare l'efficacia e la sicurezza di diversi approcci di induzione e consolidamento basati su carfilzomib in combinazione con lenalidomide e desametasone (KRd) o ciclofosfamide e desametasone (KCd) con o senza trapianto (ASCT), e del trattamento di mantenimento con carfilzomib più lenalidomide rispetto a lenalidomide da solo nel mieloma multiplo (MM) di nuova diagnosi. Lo standard di cura per questi pazienti, se candidabili, è costituito da terapia di induzione a base di bortezomib, seguita da melfalan ad alte dosi (200 mg/m2) con trapianto autologo di cellule staminali (MEL200-ASCT) e trattamento di mantenimento con il solo lenalidomide.
Metodi
UNITO-MM-01/FORTE è uno studio randomizzato, in aperto, di fase II che è stato condotto in 42 centri ematologici italiani. La popolazione oggetto di studio era rappresentata da pazienti con MM di nuova diagnosi idonei al trapianto, con età ≤65 anni e performance status (PS) di Karnofsky ≥60%. I pazienti sono stati stratificati in base all'International Staging System (I vs II/III) e all'età (<60 anni vs 60–65 anni) e randomizzati con rapporto 1:1:1 a:
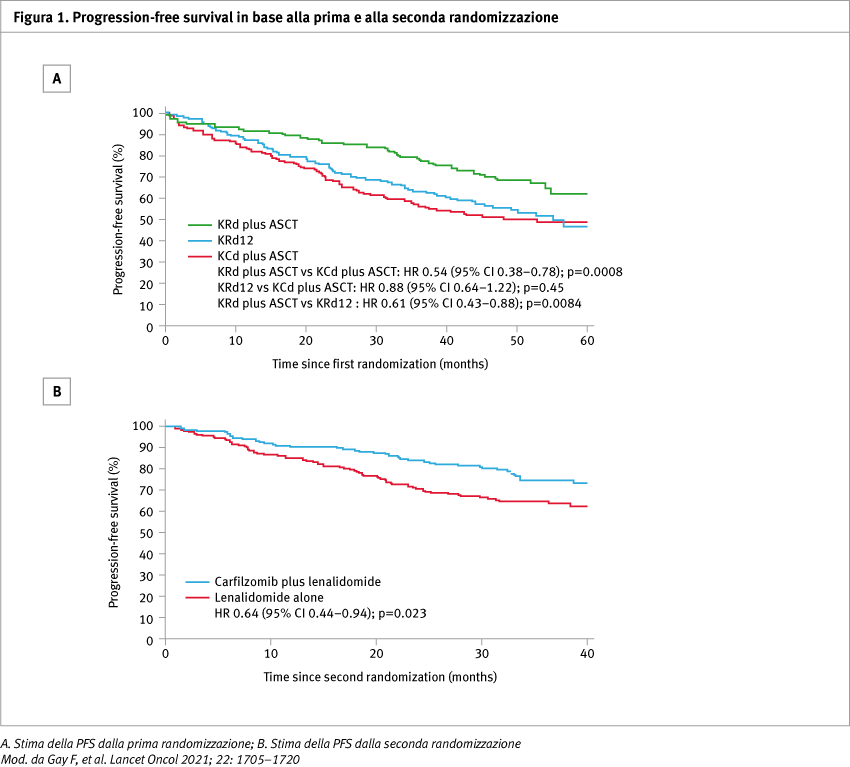
- KRd più ASCT: quattro cicli di induzione di 28 giorni con KRd, MEL200-ASCT, seguiti da quattro cicli KRd di consolidamento
- KRd12: 12 cicli KRd di 28 giorni senza MEL200-ASCT
- KCd più ASCT: quattro cicli di induzione di 28 giorni con KCd, MEL200-ASCT e quattro cicli di consolidamento con KCd di 28 giorni
Per quanto riguarda la modalità di assunzione dei farmaci, carfilzomib (36 mg/m2) veniva somministrato per via endovenosa (ev) nei giorni 1, 2, 8, 9, 15 e 16 di ogni ciclo; lenalidomide (25 mg) veniva somministrato per via orale (os) nei giorni 1-21; ciclofosfamide (300 mg/m2) veniva assunta per os nei giorni 1, 8 e 15 e desametasone (20 mg) veniva dato per os o ev nei giorni 1, 2, 8, 9, 15, 16, 22 e 23. Con una seconda randomizzazione i pazienti, stratificati in base al trattamento di induzione-consolidamento, erano assegnati a terapia di mantenimento con carfilzomib più lenalidomide o solo lenalidomide. Carfilzomib 36 mg/m2 veniva somministrato per ev nei giorni 1–2 e 15–16 ogni 28 giorni, per un massimo di due anni; lenalidomide 10 mg veniva somministrato per os nei giorni 1-21 ogni 28 giorni fino a progressione o intolleranza in entrambi i gruppi. Gli endpoints primari erano la proporzione di pazienti con almeno una risposta parziale molto buona (VGPR) dopo l'induzione con KRd rispetto a KCd e la sopravvivenza libera da progressione (PFS) con carfilzomib più lenalidomide rispetto a lenalidomide da solo come trattamento di mantenimento, entrambi valutati nella popolazione intention-to-treat. Alla pubblicazione dei dati, il reclutamento dello studio era stato completato e tutti i pazienti erano nelle fasi di follow-up o di mantenimento.
Risultati
Tra febbraio 2015 e aprile 2017, 474 pazienti sono stati arruolati in uno dei gruppi di induzione-intensificazione-consolidamento (158 a KRd più ASCT, 157 a KRd12 e 159 a KCd più ASCT). La durata mediana del follow-up è stata di 50,9 mesi (interquartile range, IQR 45,7–55,3) dalla prima randomizzazione. Per quanto riguarda gli endpoints primari, 222 (70%) dei 315 pazienti nel gruppo KRd e 84 (53%) dei 159 pazienti nel gruppo KCd hanno avuto almeno una VGPR dopo l'induzione (hazard ratio, HR 2,14; 95% confidence interval, CI: 1,44–3,19; p=0,0002). 356 pazienti sono stati assegnati in modo casuale al trattamento di mantenimento con carfilzomib più lenalidomide (n=178) o solo lenalidomide (n=178). La durata mediana del follow-up è stata di 37,3 mesi (IQR 32,9–41,9) dalla seconda randomizzazione. La PFS a tre anni è stata del 75% (95% CI: 68–82) con carfilzomib più lenalidomide rispetto al 65% (58–72) con il solo lenalidomide (HR 0,64; 95% CI: 0,44–0,94; p=0,023) (Figura 1). Per quanto riguarda la tollerabilità del trattamento nella fase di induzione e consolidamento, gli eventi avversi di grado 3-4 più comuni sono stati la neutropenia (13 con KRd più ASCT vs 10 con KRd12 vs 11% con KCd più ASCT), la tossicità dermatologica (6 vs 8 vs 1%), la tossicità epatica (8 vs 8% vs assente). Eventi avversi gravi (SAE) correlati al trattamento sono stati segnalati in 18 (11%) dei 158 pazienti nel gruppo KRd più ASCT, 29 (19%) su 156 nel gruppo KRd12 e 17 (11%) su 159 nel gruppo KCd più ASCT; il SAE più comune è stata la polmonite (4 vs 3 vs 3%). Durante il mantenimento, gli eventi avversi di grado 3-4 più comuni sono stati la neutropenia (20 con carfilzomib più lenalidomide vs 23% con lenalidomide da solo), le infezioni (5 vs 7%) e gli eventi vascolari (7 vs 1%). Sono stati segnalati SAE nel 14% dei pazienti trattati con la terapia di combinazione e nell'8% dei pazienti assegnati al gruppo con solo lenalidomide. Anche in questo caso la polmonite è stato il SAE più comune, con un’incidenza del 3% in entrambi i gruppi. Per quanto riguarda i decessi correlati al trattamento, sono stati sette nella fase di induzione (1, 1 e 2% con KRd, KRd12 e KCd, rispettivamente) e un singolo paziente nella fase di mantenimento nel gruppo carfilzomib più lenalidomide.
Conclusioni
I risultati dello studio FORTE hanno mostrato superiorità in termini di risposte profonde e durature della combinazione KRd più ASCT rispetto agli altri due approcci terapeutici, senza un elevato carico di tossicità (Tabella 1). In mantenimento, la combinazione carfilzomib-lenalidomide ha inoltre migliorato la PFS rispetto all’attuale standard di cura con solo lenalidomide. Questi dati supportano la valutazione prospettica e randomizzata di KRd più ASCT (con o senza l’aggiunta di un anti-CD38) rispetto a standard di cura come daratumumab, bortezomib, talidomide e desametasone (daraVTD) più ASCT o lenalidomide, bortezomib e desametasone più ASCT nei pazienti con MM idonei a trapianto. Inoltre, la terapia a base di carfilzomib è particolarmente efficace anche nei pazienti ad alto rischio i quali al momento rappresentano uno dei principali unmet clinical needs nella gestione del mieloma.



