Numero speciale di "Impact Factor News” n° 1 - Aprile 2023
Introduzione
I pazienti con il mieloma multiplo triplo-refrattari o pluri-recidivati hanno una prognosi sfavorevole e la recidiva è un evento comune anche in coloro che ricevono le terapie più innovative. Talquetamab è un anticorpo bispecifico umanizzato, first-in-class, progettato per mediare il killing delle cellule T verso il GPRC5D, altamente espresso dalle plasmacellule. Nello studio di fase I/II MonumenTAL-1, il nuovo anticorpo bispecifico che ingaggia cellule T (BiTe) ha indotto risposte in oltre il 70% dei pazienti con mieloma multiplo pesantemente pretrattati. I risultati sono stati recentemente pubblicati sul New England Journal of Medicine.
Metodi
Lo studio di fase I-II MonumenTAL-1 ha valutato talquetamab somministrato per via endovenosa settimanalmente o a settimane alterne (dosi da 0,5 a 180 μg/kg) oppure somministrato per via sottocutanea settimanale, a settimane alterne o a cadenza mensile (dosi da 5 a 1600 μg/kg) nei pazienti con mieloma multiplo recidivato refrattario (MMRR) pesantemente pretrattato e progredito con le terapie convenzionali o non trattabile con le terapie convenzionali per intolleranza (numero mediano di linee precedenti pari a 6, range: 2–20). Lo studio è stato suddiviso in una prima fase di dose-finding e una seconda fase di dose-expansion. Gli endpoints primari sono stati la frequenza e il tipo di effetti tossici dose-limitanti (per la parte di dose-finding) e gli eventi avversi e le anomalie di laboratorio, al fine di selezionare le dosi raccomandate per uno studio di fase II. Il principale endpoint secondario dello studio è stata la valutazione del tasso di risposte.
Risultati
Al cut-off dei dati, 232 pazienti sono stati trattati con talquetamab (102 per via endovenosa e 130 per via sottocutanea). Con le due dosi sottocutanee raccomandate per lo studio di fase II (405 μg/kg a settimana per 30 pazienti e 800 μg/kg a settimane alterne per 44 pazienti), gli eventi avversi comuni sono stati la sindrome da rilascio di citochine (CRS) nel 77 e nell'80% dei pazienti, rispettivamente, gli eventi cutanei nel 67 e nel 70% e la disgeusia nel 63 e nel 57% (Tabella 1).
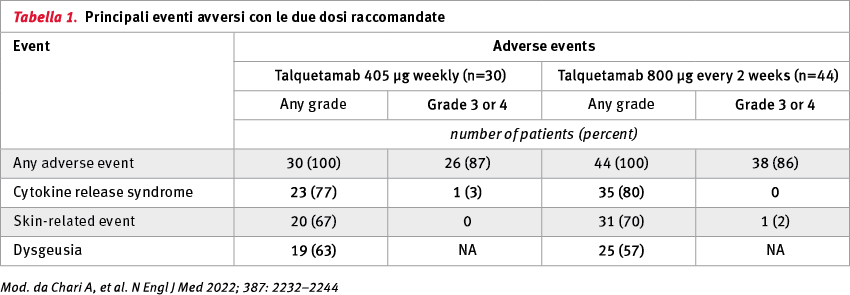
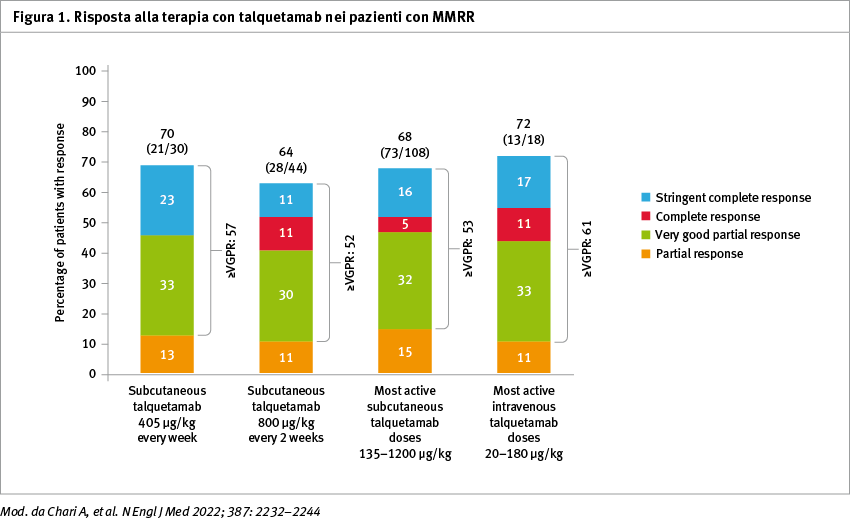
Per quanto riguarda le CRS, si trattava prevalentemente di eventi di grado 1 e 2. É stato, inoltre, riportato un effetto avverso cutaneo di grado 3 (dose-limitante) in un paziente che aveva ricevuto talquetamab al livello di dose di 800 μg. Gli eventi avversi di grado 3 e 4 sono stati principalmente tossicità ematologiche. Con un follow-up mediano di 11,7 mesi (nei pazienti che avevano ricevuto talquetamab al livello di dose di 405 μg) e di 4,2 mesi (in coloro che l'avevano ricevuto al livello di dose di 800 μg), le percentuali di pazienti che hanno ottenuto almeno una risposta sono state del 70% (confidence interval, CI 95%: 51–85) e 64% (CI 95%: 48–78), rispettivamente. La durata mediana della risposta è stata, rispettivamente, di 10,2 e 7,8 mesi (Figura 1).
Conclusioni
Talquetamab è un nuovo bispecifico disponibile off-the-shelf, diretto contro il GPRC5D. Nello studio MonumenTAL-1, il farmaco ha dimostrato un effetto antitumorale sostanziale in pazienti con MMRR pesantemente pretrattati. La CRS e gli eventi di tossicità cutanea e disgeusia sono stati comuni ma principalmente di basso grado con le dosi di talquetamab identificate nello studio come dosi raccomandate, in base al profilo di efficacia e tossicità. L’efficacia del BiTe, in aggiunta ai dati ottenuti con le CAR-T, valida il GPRC5D come target terapeutico nel mieloma multiplo.


