Numero speciale di "Impact Factor News” n° 4 - Ottobre 2017
Introduzione
Il linfoma T cutaneo è una patologia rara, classicamente incurabile, associata a una mediocre qualità di vita. Le attuali terapie sistemiche raramente permettono di ottenere delle risposte efficaci e durature nel tempo. In questo lavoro gli Autori hanno voluto testare, in un trial randomizzato, l’efficacia e la sicurezza di brentuximab vedotin paragonato alla terapia convenzionale, lasciando ai centri partecipanti libertà nella scelta del trattamento considerato lo standard di confronto e ne hanno riportato i risultati.
Metodi
In questo studio clinico internazionale randomizzato multicentrico di fase 3, gli Autori hanno arruolato pazienti affetti da micosi fungoide CD30-positivi o linfoma anaplastico a grandi cellule primitivo cutaneo. I paesi coinvolti sono stati 13 e i centri arruolanti 52. I pazienti sono stati assegnati al farmaco sperimentale o al trattamento di riferimento nel singolo centro in modo randomizzato con un rapporto di 1:1, attraverso un’assegnazione centralizzata data dal web. Brentuximab vedotin è stato somministrato per via endovenosa alla dose standard di 1,8 mg/kg ogni tre settimane per un totale di 16 cicli. Le terapie di riferimento dichiarate sono state: metotrexato per os alla dose di 5-50 mg giornalieri alla settimana o di bexarotene 300 mg/m2 una volta al giorno sempre per via orale per 48 settimane. L’obiettivo primario dello studio era la proporzione di pazienti in intention-to-treat che otteneva una risposta globale oggettiva della durata di almeno quattro mesi, con un panel di revisori indipendente dallo sponsor. L’analisi della sicurezza è stata effettuata per tutti i pazienti che avessero effettuato almeno un ciclo di terapia. Lo studio è registrato su ClinicalTrials.gov, numero NCT01578499.
Risultati
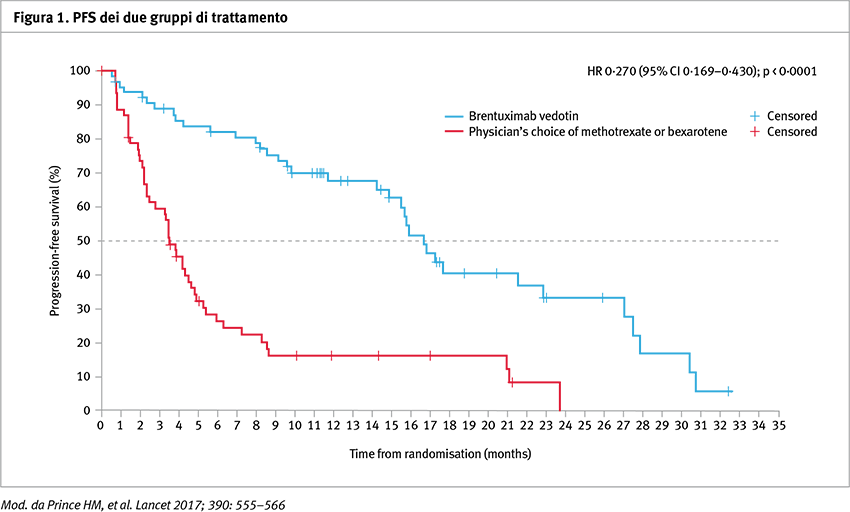
Tra il 13 agosto 2012 e il 31 luglio 2015, 131 pazienti sono stati randomizzati e assegnati ai due bracci di terapia: 66 pazienti a brentuximab vedotin e 65 alla terapia di riferimento dichiarata per centro. In totale 128 pazienti sono stati analizzati in intention-to-treat (64 per ciascun gruppo). Alla mediana di follow-up pari a 22,9 mesi (95% CI 18,4–26,1), la proporzione di pazienti che aveva ottenuto una riposta globale oggettiva della durata di almeno 4 mesi era 56,3% (36/64 pazienti) nel braccio brentuximab vedotin versus 12,5% (8/64) nel braccio confronto con terapia di riferimento, con una differenza statisticamente significativa pari al 43,8% (95% CI 29,1–58,4; p <0,0001), (Figura 1).
Per quanto concerne i dati di tossicità, eventi avversi di grado 3–4 sono stati riportati in 27 (41%) dei 66 pazienti del gruppo trattato con brentuximab vedotin e 29 (47%) dei 62 pazienti trattati nel gruppo di confronto con terapia di riferimento dichiarata da ciascun centro. La neuropatia periferica è stata registrata in 44 su 66 pazienti (67%) del gruppo brentuximab vedotin (n=21 grado 2, n=6 grado 3) e in 4 su 62 pazienti (6%) del gruppo di confronto. Sono stati registrati quattro decessi nel gruppo brentuximab vedotin, di cui solo una morte è stata correlata al farmaco, mentre non si sono registrati decessi nel gruppo di confronto.
Conclusioni
Il trial ha permesso di evidenziare come brentuximab vedotin abbia ottenuto delle risposte oggettive significativamente superiori e della durata di almeno quattro mesi rispetto ai due farmaci di riferimento: metotrexato e/o bexarotene.