Numero speciale di "Impact Factor News” n° 4 - Ottobre 2017
Obiettivo
In questo lavoro gli Autori hanno voluto esplorare l’impatto prognostico di tre fattori biologici alla diagnosi e la loro reciproca influenza prognostica in due studi clinici prospettici randomizzati nel trattamento di prima linea del linfoma diffuso a grandi cellule B (DLBCL). Intendendo come fattori biologici alla diagnosi: 1. la classificazione secondo la cellula di origine (COO); 2. la doppia iperespressione (DE) delle proteine MYC e BCL2; 3. le traslocazioni di MYC, BCL2 e BCL6.
Pazienti e metodi
Complessivamente 452 preparati istologici fissati a fresco in formalina sono stati disponibili per l’analisi da due trial clinici prospettici randomizzati del gruppo Tedesco dei Linfomi DLBCL: RICOVER-60, studio prospettico, randomizzato per pazienti con più di 60 anni, indipendentemente dall’IPI (International Prognostic Index) e lo Studio R-MegaCHOEP, prospettico, randomizzato, per pazienti di età ≤60 anni con IPIaa 2,3. La tecnica di analisi utilizzata per determinare la COO è stata il Lymph2Cx assay, per l’iperespressione di MYC e BCL2 (DE) l’immunoistochimica e la FISH per determinare i riarrangiamenti di MYC, BCL2, e BCL6.
Risultati
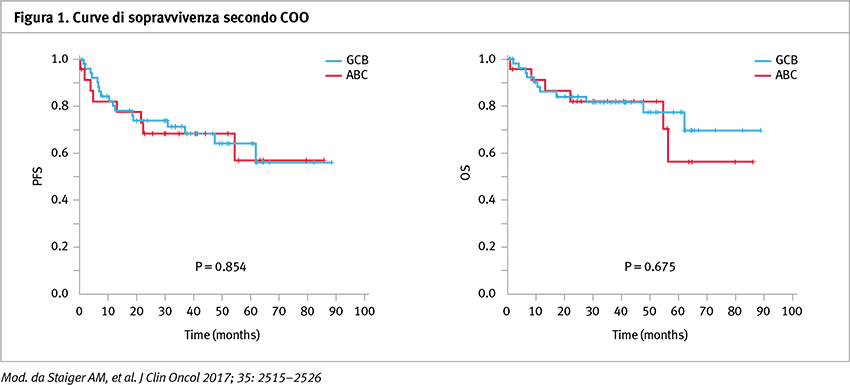
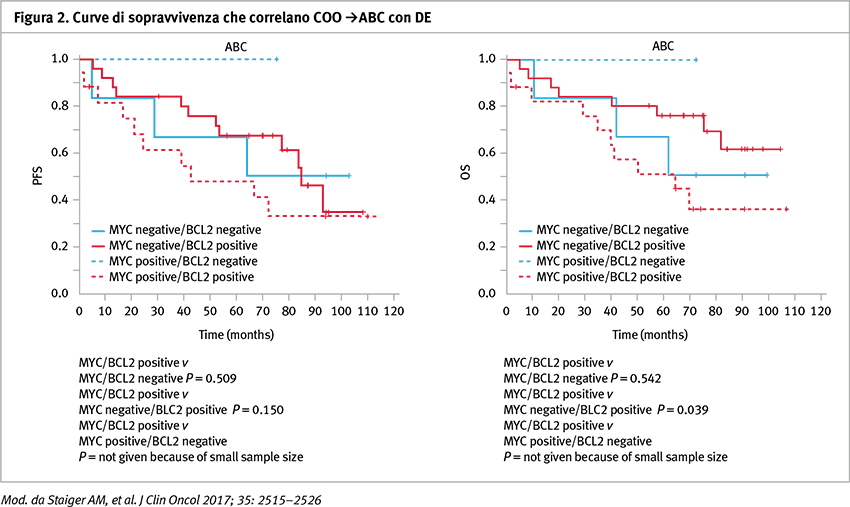
Per quanto concerne la prima metodica di analisi (Lymph2Cx assay), è stata possibile applicarla in 414 su 452 campioni disponibili. Non sono state osservate differenze significative tra i pazienti con DLBCL activated B-cell (ABC)-like e quelli con linfoma DLBCL germinal center B-cell (GCB)-like trattati con lo schema R-CHOP14 nello studio RICOVER-60, sia per il calcolo della sopravvivenza libera da eventi (EFS), sia per la sopravvivenza libera da progressione (PFS) e per la sopravvivenza globale (OS) (Figura 1). Inoltre, non sono state osservate differenze in analisi multivariata rispetto all’indice IPI in EFS (hazard ratio [HR] di ABC-like versus GCB-like, 1,0; 95% CI, 0,6–1,6; p=0,93), PFS (HR, 1,1; 95% CI, 0,6–1,8; p=0,82) e in OS (HR, 1,0; 95% CI, 0,6–1,8; p=0,96). Risultati analoghi si sono osservati nella coorte di pazienti del trial con R-MegaCHOEP. Nei pazienti trattati con R-CHOP, lo stato di DE era associato con una sopravvivenza globale significativamente ridotta quando paragonato ai pazienti che non presentavano la doppia espressione di MYC e BCL2 nel sottogruppo GCB, ma non nel sottogruppo ABC. Lo stato DE era associato con una prognosi significativamente inferiore paragonato a pazienti con linfoma ABC-like DLBCL senza la DE (PFS a 5 anni, 39% [95% CI, 19–59%] versus 68% [95% CI, 52–85%]; p=0,03) (Figura 2) e a quelli con GCB-like DLBCL sempre senza la DE. Nell’analisi separata dei pazienti senza la doppia espressione di DE la prognosi dei pazienti del sottogruppo ABC era inferiore a quello del gruppo GCB (PFS a 5 anni 68% [95% CI, 52–85%] versus 85% [95% CI, 74–96%]; p=0,04).
Conclusioni
Il fattore biologico denominato COO ha fallito nell’identificare differenti sottogruppi prognostici in due studi prospettici randomizzati sul trattamento in prima linea del DLBCL, al contrario la doppia espressione di MYC e BCL2 ha predetto un outcome sfavorevole nei pazienti positivi dei due studi presi in esame. Il ruolo dei biomarcatori prognostici o predittivi nel trattamento dei linfomi diffusi a grandi cellule B come COO, deve ancora essere chiarito nel contesto di studi clinici prospettici controllati, perché i dati a oggi disponibili non hanno ancora permesso di dirimere con certezza e solidità il loro ruolo e il loro reale impatto sulla sopravvivenza.