Numero speciale di "Impact Factor News” n° 4 - Ottobre 2017
La chemioterapia ad alte dosi e il trapianto di cellule staminali autologhe sono da anni il trattamento standard per i pazienti fino a 65 anni di età affetti da mieloma multiplo di nuova diagnosi. L’introduzione di nuove categorie di farmaci caratterizzati da notevole efficacia terapeutica e il loro uso in combinazione mette in dubbio l’utilità e la corretta tempistica di esecuzione del trapianto autologo. Lo studio IFM2009 ha posto a confronto la somministrazione di lenalidomide bortezomib e desametasone (RVD) da sola o in associazione a consolidamento con trapianto, per rispondere a questo quesito. Lo studio, pubblicato da Attal sul NEJM, ha messo in evidenza come le percentuali di risposta e sopravvivenza libera da progressione (PFS) siano significativamente migliori nel gruppo di pazienti sottoposto a trapianto, benché questo non si traduca in un incremento della sopravvivenza (OS).
Metodi
Lo studio randomizzato, aperto, multicentrico, ha arruolato 700 pazienti con mieloma multiplo. I pazienti sono stati stratificati in funzione all’ISS e al profilo di rischio citogenetico classificato come alto (t[4;14] o t[14;16], o delezione 17p), standard o non definito (failure dell’analisi citogenetica/FISH) e randomizzati con rapporto 1:1 nei due seguenti bracci di trattamento:
Braccio sola RVD (350 pazienti): RVD x 3 cicli + RVD x 5 cicli (consolidamento)
Braccio trapianto (350 pazienti): RVD x 3 cicli + trapianto di cellule staminali (melphalan) + RVD x 2 cicli
In entrambi i gruppi dopo i cicli di induzione i pazienti venivano sottoposti a raccolta delle staminali autologhe previa mobilizzazione con ciclofosfamide e GCSF.
Indipendentemente dalla strategia di consolidamento i pazienti hanno ricevuto un mantenimento con lenalidomide per un anno.
L’endpoint principale era la PFS.
Risultati
Circa il 90% dei pazienti di ciascun braccio ha completato il trattamento pianificato.
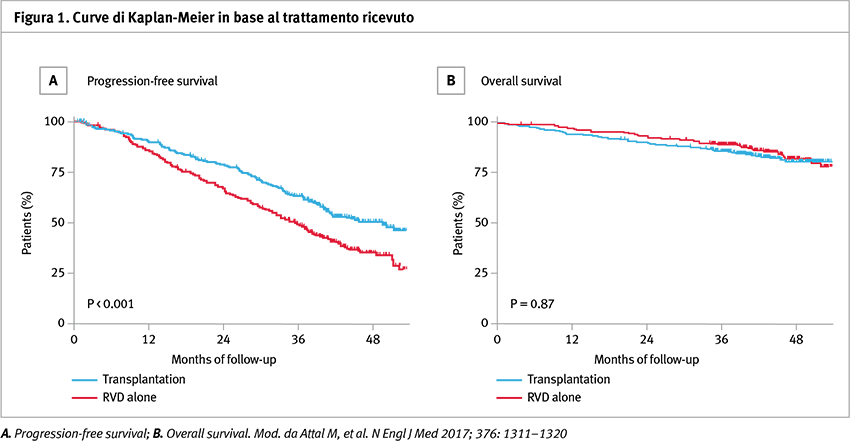
La PFS mediana era significativamente più lunga nel gruppo sottoposto a trapianto rispetto al gruppo che ha ricevuto solo RVD (50 vs 36 mesi; hazard ratio (HR) per progressione di malattia o morte, 0,65; p <0,001). Questo vantaggio è stato osservato in tutti i sottogruppi dei pazienti.
La percentuale di risposta completa era più elevata nel gruppo sottoposto a trapianto rispetto al gruppo RVD-alone (59 vs 48%, p=0,03), così come la percentuale di pazienti con minima malattia residua negativa (79 contro 65%, p <0,001).
Nel braccio RVD 207 pazienti sono progrediti, di questi 172 sono stati sottoposti a un trattamento di seconda linea e 136 (il 79%) hanno ricevuto un trapianto di salvataggio.
Nel gruppo sottoposto al trapianto, i pazienti che hanno mostrato una progressione della malattia sono stati 149, 123 hanno ricevuto un trattamento di seconda linea e, di questi, 21 (il 17%) hanno fatto un secondo trapianto.
La sopravvivenza complessiva a quattro anni non differiva significativamente tra il gruppo trapianto e il gruppo RVD-alone (81 e 82% rispettivamente).
Nei pazienti che ottenevano la negativizzazione della malattia minima residua (metodica immunofenotipica sensibilità 1x10-4) l’OS era più lunga (adjusted HR=0,34, p <0,001).
In merito alle tossicità, il tasso di neutropenia di grado 3 o 4 era significativamente più elevato nel gruppo di trapianto rispetto al gruppo RVD-alone (92 vs 47%), così come l’incidenza di disturbi gastrointestinali di grado 3 o 4 (28 vs 7%) e infezioni (20 vs 9%). Non è stata osservata nessuna differenza significativa tra i gruppi per quanto riguarda mortalità, secondi tumori primari, eventi tromboembolici e neuropatia periferica.
Conclusioni
Nel mieloma multiplo, la terapia con RVD e il trapianto è stata associata a sopravvivenza libera da progressione significativamente più lunga rispetto alla terapia con solo RVD, ma la sopravvivenza globale non differisce significativamente tra i due approcci.