Numero speciale di "Impact Factor News” n° 4 - Ottobre 2019
Background
Il trattamento di prima linea dei pazienti con mieloma non candidabile a trapianto prevede l’utilizzo della tripletta di VMP o la combinazione lenalidomide e desametasone (RD). Lo studio ALCYONE ha dimostrato recentemente come l’aggiunta di daratumumab a VMP comporti un miglioramento negli outcome clinici in prima linea. Analogamente lo studio MAIA ha valutato, nello stesso setting di pazienti, la sicurezza dell’aggiunta di daratumumab a RD e il suo impatto sul rischio di progressione della malattia o di morte. Qui riassumiamo i risultati favorevoli dello studio MAIA, dati pubblicati da Facon sul NEJM.
Metodi
Lo studio ha arruolato 737 pazienti con mieloma multiplo di nuova diagnosi non idonei a trapianto autologo e li ha randomizzati con rapporto 1:1 a ricevere daratumumab, lenalidomide e desametasone (gruppo daratumumab) o lenalidomide e desametasone (gruppo di controllo). Il trattamento continuava fino al verificarsi di progressione della malattia o effetti di collaterali gravi. L'obiettivo primario dello studio era la progression-free survival (PFS).
Risultati
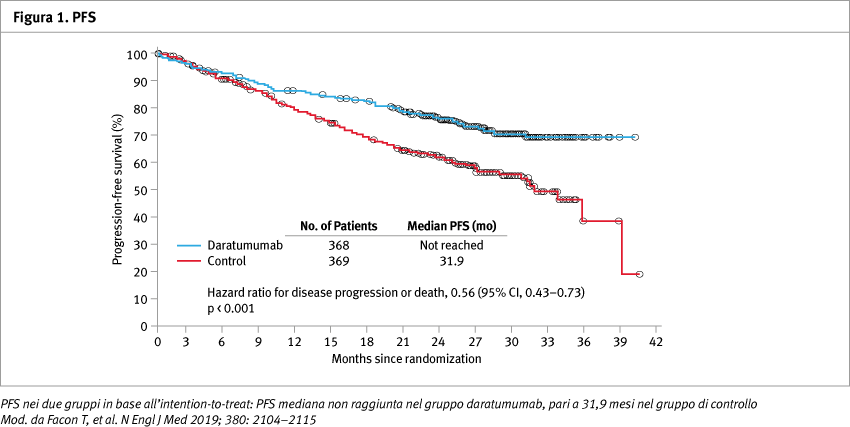
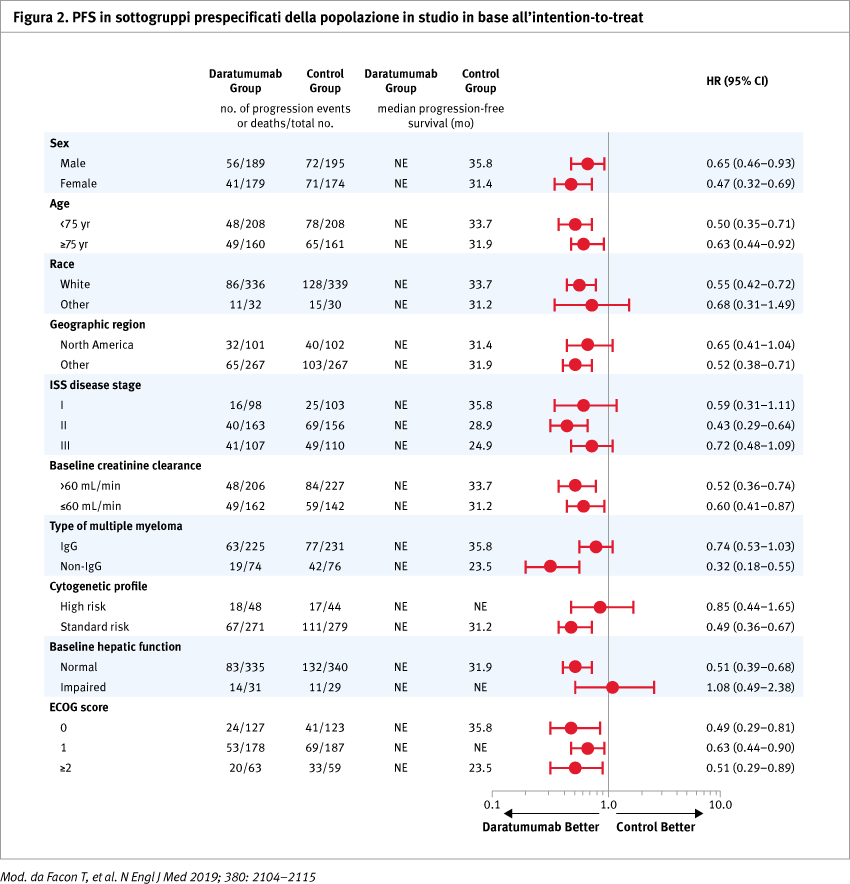
Con un follow-up mediano di 28,0 mesi, 240 pazienti sono progrediti o sono deceduti per malattia, rispettivamente 97 dei 368 pazienti (26,4%) nel gruppo daratumumab e 143 pazienti su 369 (38,8%) nel gruppo di controllo. La PFS stimata a 30 mesi nel gruppo daratumumab era del 70,6% (95% IC, 65,0–75,4) e nel gruppo di controllo 55,6% (95% IC, 49,5–61,3) con una riduzione del rischio di progressione o di morte del 44% (HR progressione o morte 0,56; 95% IC, 0,43–0,73; p <0,001). Il miglioramento della PFS si confermava anche nel sottogruppo di pazienti con età ≥75 anni (HR 0,63; 95% IC, 0,44–0,92) (Figure 1 e 2).
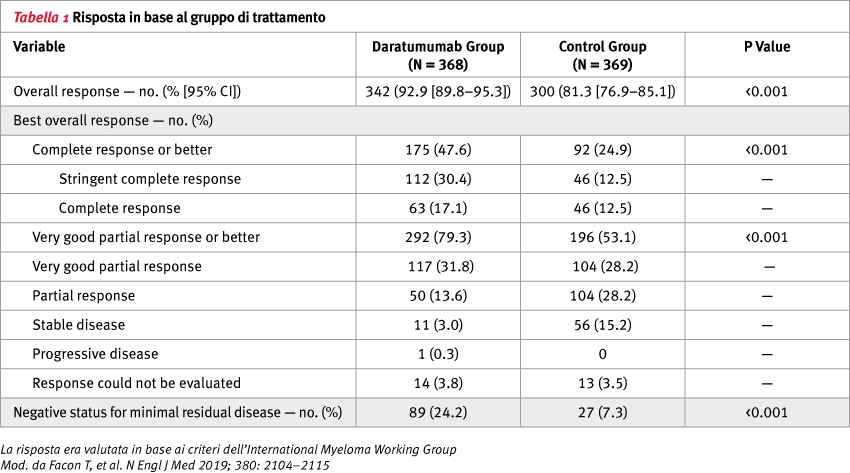
Inoltre, per quanto riguarda la risposta al trattamento, nel braccio daratumumab sono stati ottenuti dei risultati migliori con una percentuale di pazienti con una risposta completa o maggiore del 47,6% verso il 24,9% nel gruppo di controllo (p <0,001). Analogamente la malattia minima residua si è negativizzata nel 24,2% dei pazienti del gruppo daratumumab rispetto al 7,3% del gruppo di controllo (1 cellula tumorale per 105 globuli bianchi) (p <0,001) (Figura 3).
Per quanto riguarda la sicurezza, le problematiche osservate erano analoghe a quelle riportate con RD e con daratumumab in monoterapia con conseguente incremento della percentuale di neutropenia e polmonite nel gruppo daratumumab.
Gli eventi avversi più comuni di grado 3 o 4 con daratumumab e con la terapia standard sono stati rispettivamente:
- neutropenia (50,0 vs 35,3%)
- anemia (11,8 vs 19,7%)
- linfopenia (15,1 vs 10,7%)
- polmonite (13,7 vs 7,9%).
Conclusioni
Nei pazienti con MM di nuova diagnosi non candidabili al trapianto di cellule staminali autologhe, l’aggiunta di daratumumab alla terapia standard si associa a una riduzione statisticamente significativa del rischio di progressione di malattia o di morte. La tripletta comporta una maggiore incidenza di neutropenia e polmonite.