Numero speciale di "Impact Factor News” n° 4 - Ottobre 2021
Introduzione
Lo studio CARTITUDE-1 è stato condotto per valutare la sicurezza e l'attività clinica di ciltacabtagene autoleucel (cilta-cel), a base di cellule T che esprimono un recettore chimerico per l'antigene (CAR-T) diretto verso l'antigene di maturazione delle cellule B (BCMA), in pazienti affetti da mieloma multiplo (MM) recidivato/refrattario (R/R) a prognosi infausta.
Metodi
Questo studio a braccio singolo, in aperto, di fase Ib/II, ha arruolato pazienti di età pari o superiore a 18 anni, con una diagnosi di MM ed ECOG performance status (PS) pari a 0/1, che avessero ricevuto almeno tre linee di terapia o che fossero doppiamente refrattari a un inibitore del proteasoma e a un farmaco immunomodulatore, e avessero ricevuto un inibitore del proteasoma, un farmaco immunomodulatore e un anticorpo anti-CD38. Una singola infusione di cilta-cel (dose target 0,75 × 10⁶ cell/kg, range 0,5–1,0×106 cell/kg) veniva somministrata 5–7 giorni dopo l'inizio della linfodeplezione. Gli endpoints primari erano la tollerabilità (incidenza e severità degli eventi avversi) e la conferma della dose raccomandata, nella fase I; nella fase II, l’overall response rate (ORR) in tutti i pazienti trattati. Gli endpoints secondari principali erano la durata della risposta e la progression-free survival (PFS).
Risultati
Lo studio ha arruolato 113 pazienti, di cui 97 (29 nella fase Ib e 68 nella fase II) hanno ricevuto un'infusione di cilta-cel alla dose raccomandata di fase II di 0,75 × 10⁶ cell/kg. Al cut-off clinico del 01/09/2020, il follow-up mediano era di 12,4 mesi. I 97 pazienti trattati avevano ricevuto una mediana di sei terapie precedenti (range 3–18). L’età mediana era di 61 anni (range 43–78). Per quanto riguarda l’efficacia, l’ORR è stato del 97% (95% confidence interval, CI 91,2–99,4) con il 67% dei pazienti con risposta completa stringente (sCR), il 26% dei pazienti con risposta parziale molto buona (VGPR) e il 4% dei pazienti con risposta parziale (PR). Nei 57 pazienti valutabili per l’MRD, 93% hanno ottenuto una MRD negativa. Il tempo alla prima risposta è stato di un mese e il tempo mediano alla migliore risposta di 2,6 mesi (1–6,1). La durata mediana della risposta non è stata raggiunta (95% CI 15,9–non estimabile, NE), insieme alla PFS (16,8–NE). Il tasso di PFS a 12 mesi era del 77% (95% CI 66,0–84,3) e il tasso di overall survival (OS) era dell'89% (80,2–93,5) (Figura 1). Gli eventi avversi ematologici di grado 3–4 erano comuni e includevano neutropenia nel 95% dei pazienti, anemia nel 68%, trombocitopenia nel 60% e linfopenia nel 50%. Gli eventi avversi non ematologici di interesse speciale comprendevano la sindrome da rilascio di citochine (CRS) e la neurotossicità, entrambe comunemente associate alle CAR-T. In 92 dei 97 pazienti (96%) si è verificata CRS, ma solo nel 4% era di grado 3 o 4, il tempo mediano all'insorgenza era di sette giorni (range 5–8) e durata mediana di quattro giorni (range 3–6). La CRS si è risolta in tutti tranne in un paziente con CRS di grado 5 e linfoistiocitosi emofagocitica. La neurotossicità si è verificata in 20 pazienti (21%) ed era di grado 3 o 4 nel 9% dei casi. Nello studio si sono verificati 14 decessi: sei a causa di eventi avversi correlati al trattamento, cinque per malattia progressiva e tre a causa di eventi avversi non correlati al trattamento.
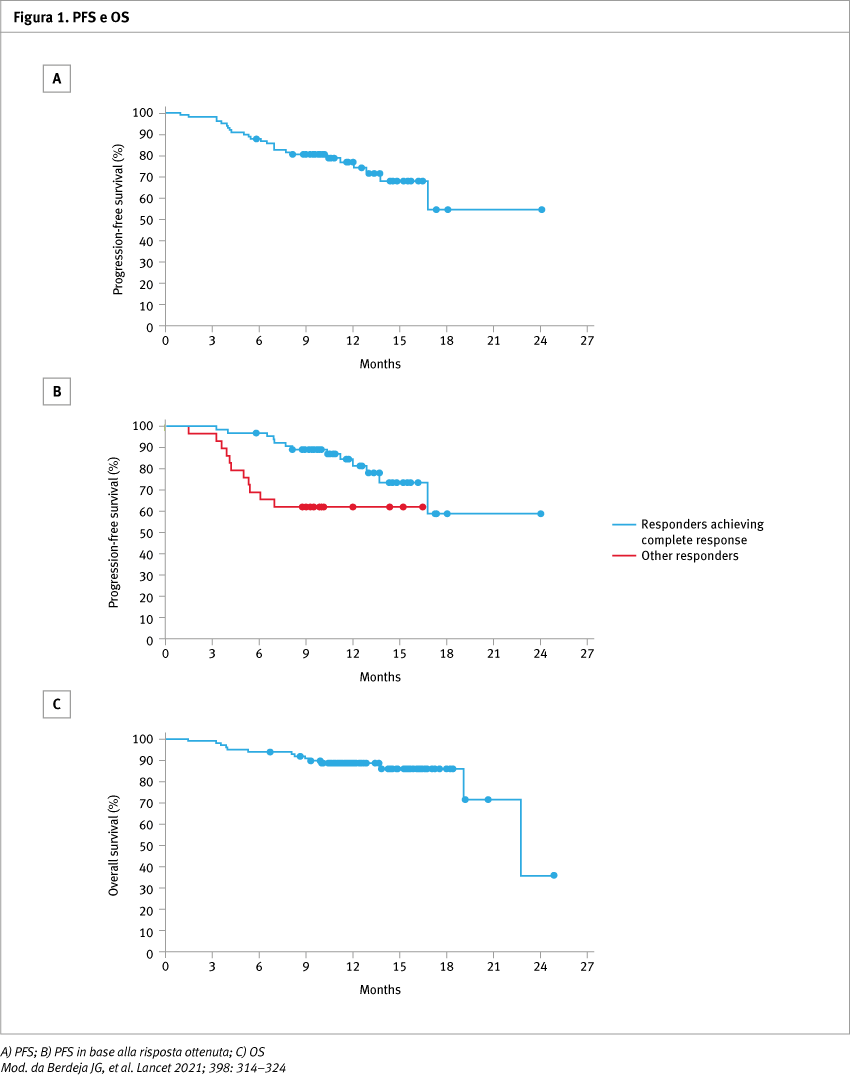
Conclusioni
Una singola infusione di cilta-cel alla dose target di 0,75 × 10⁶ cell/kg ha portato a risposte precoci, profonde e durature in pazienti con MM R/R pesantemente pretrattati. Il profilo di sicurezza era gestibile. I dati di questo studio hanno costituito la base per le recenti richieste di regolamentazione.


