Numero speciale di "Impact Factor News” n° 4 - Ottobre 2021
Introduzione
I pazienti con linfoma diffuso a grandi cellule B (DLBCL) recidivato/refrattario (R/R) dopo le terapie di salvataggio hanno una prognosi sfavorevole. Loncastuximab tesirina è un anticorpo farmaco-coniugato (ADC) composto da un anticorpo umanizzato anti-CD19 coniugato alla citotossina pirrolobenzodiazepina, la cui attività è stata considerata interessante in questo setting di pazienti negli studi di fase I. In base a questi presupposti, l'attività antitumorale e la sicurezza di loncastuximab tesirina sono state testate nello studio LOTIS-2.
Metodi
Lo studio multicentrico, di fase II, ha arruolato pazienti di età pari o superiore a 18 anni affetti da DLBCL R/R dopo due o più terapie sistemiche e con malattia misurabile. I pazienti idonei hanno ricevuto loncastuximab tesirina per via endovenosa ogni 21 giorni, al dosaggio di 150 μg/kg per i primi due cicli, e successivamente al dosaggio di 75 μg/kg per un anno o fino a recidiva/progressione della malattia, o tossicità inaccettabile. L'endpoint primario era l’overall response rate (ORR) valutato mediante revisione centrale. L'attività antitumorale e le analisi di sicurezza sono state eseguite su tutti i pazienti che avevano ricevuto almeno una dose, quando tutti i pazienti avevano almeno sei mesi di follow-up dalla documentazione iniziale della risposta.
Risultati
Nello studio sono stati arruolati e trattati con almeno una dose di farmaco 145 pazienti, inclusi pazienti con caratteristiche ad alto rischio (double-hit, triple-hit, trasformati o DLBCL primariamente refrattari). L’ORR è stato del 48,3% (95% confidence interval, CI 39,9–56,7), con il 24,1% di risposte complete e il 24,1% di risposte parziali. Il tempo mediano alla risposta è stato di 1,3 mesi e la durata della risposta (DoR) mediana è stata di 10,3 mesi (Figura 1). Gli eventi avversi più comuni di grado 3 o superiore emersi dal trattamento sono stati la neutropenia (26%), la trombocitopenia (18%) e l’aumento della GGT (17%). In 57 pazienti (39%) si sono verificati eventi avversi gravi, otto dei quali con esito fatale (6%), di cui nessuno è stato considerato correlato a loncastuximab. Il 23% dei pazienti ha interrotto il trattamento in conseguenza di eventi avversi, e l’8% ha ridotto la dose.
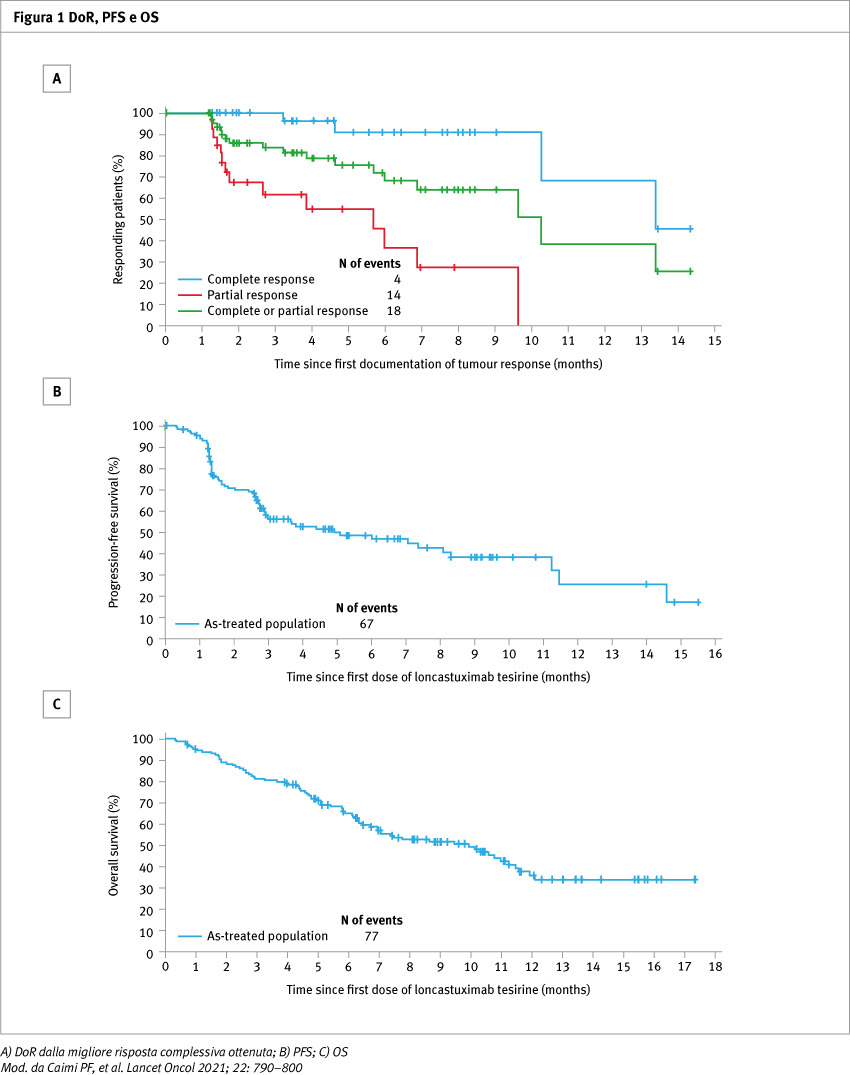
Conclusioni
Loncastuximab tesirina ha una sostanziale attività antitumorale in monoterapia e produce risposte durature con un profilo di sicurezza accettabile e gestibile, offrendo una nuova potenziale opzione terapeutica per pazienti pesantemente pretrattati affetti da DLBCL R/R. Lo studio ha portato all’approvazione di loncastuximab da parte della Food and Drug Administration (FDA).


