Introduzione
Obecabtagene autoleucel (obe-cel) è una terapia con CAR-T anti-CD19 41BB-ζ autologa. A differenza di tisagenlecleucel e brexucabtagene autoleucel, che utilizzano lo stesso frammento variabile a catena singola (scFv) ad alta affinità per il riconoscimento del CD19, obe-cel impiega uno scFv diverso ad affinità intermedia caratterizzato da un rapido tasso di dissociazione, il che si ipotizza possa ridurre gli effetti collaterali e migliorare l’attecchimento e la persistenza delle cellule CAR-T. Nello studio FELIX, disegnato per la registrazione del trattamento, obe-cel ha mostrato un'alta incidenza di risposte durature negli adulti con leucemia linfoblastica acuta a cellule B (B-ALL) recidivante o refrattaria (R/R), con effetti collaterali riscontrati prevalentemente nei pazienti con un alto carico midollare di malattia.
Metodi
Lo studio FELIX, multicentrico, di fase 1b-2 ha testato obe-cel in adulti (≥18 anni) con B-ALL R/R. La coorte principale, la coorte 2A, comprendeva pazienti con malattia morfologica; la coorte 2B comprendeva i pazienti con malattia residua misurabile (MRD). L’endpoint primario dello studio era il tasso di risposta completa (CR) (CR o CR con recupero ematologico incompleto) nella coorte 2A. Gli endpoints secondari includevano la sopravvivenza libera da eventi (EFS), la sopravvivenza globale (OS) e la sicurezza.
Risultati
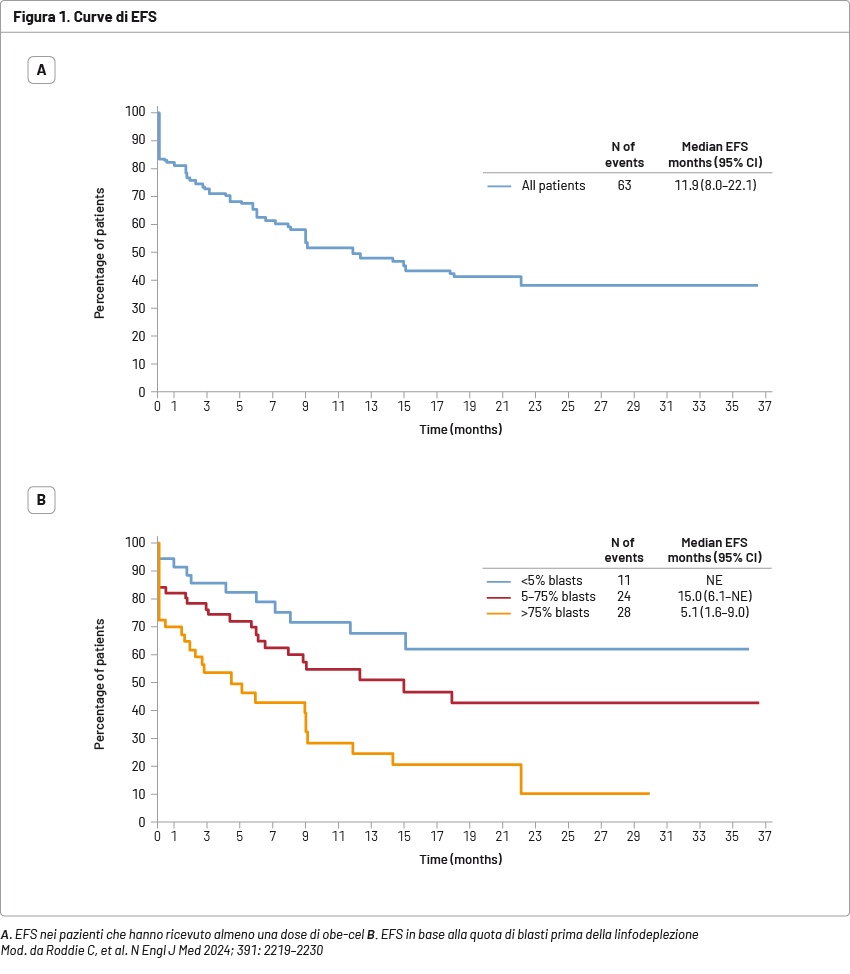
Lo studio FELIX ha arruolato 153 pazienti, di cui 127 (83,0%) avevano ricevuto almeno un’infusione di obe-cel ed erano valutabili. L’età mediana era di 47 anni (20-81) e i pazienti avevano ricevuto una mediana di due precedenti linee di terapia (2–6). Il 41,7% dei pazienti aveva precedentemente ricevuto blinatumomab, il 31,5% inotuzumab ozogamicin e il 16,5% entrambi. Inoltre, 56 pazienti (44,1%) erano stati sottoposti a trapianto allogenico di cellule staminali. Nella coorte 2A sono stati inclusi 94 pazienti (follow-up mediano di 20,3 mesi); il tasso di CR era del 77% (CR nel 55% e CR con recupero ematologico incompleto nel 21%). Nei 127 pazienti che hanno ricevuto almeno un’infusione di obe-cel nelle due coorti (follow-up mediano di 21,5 mesi), la EFS mediana è stata di 11,9 mesi (confidence interval [CI] 95%: 8,0–22,1), la EFS stimata a 6 e 12 mesi è stata pari al 65,4 e al 49,5%, rispettivamente (Figura 1A). La OS mediana è stata di 15,6 mesi (CI 95%: 12,9–non valutabile [NE]), la OS stimata a 6 e 12 mesi è stata pari all’80,3 e al 61,1%, rispettivamente. I pazienti con basso carico midollare (<5% di blasti) o con carico midollare intermedio (5–75% di blasti), valutato prima della linfodeplezione. hanno mostrato una migliore EFS rispetto a quelli con alto carico midollare (>75% di blasti) (Figura 1B).
Diciotto pazienti sono stati sottoposti a trapianto allogenico di cellule staminali mentre erano in remissione; per 6 pazienti su 18 (33%) si è trattato di un secondo trapianto. Per quanto riguarda la tollerabilità del trattamento, la sindrome da rilascio di citochine (CRS) si è verificata in 87/127 pazienti (68,5%), con eventi di grado 3 o superiore solo nel 2,4% dei pazienti, mentre l’incidenza della sindrome da neurotossicità associata alle cellule effettrici immunitarie (ICANS) di grado 3 o superiore è stata del 7,1%. La forma grave di ICANS è stata prevalentemente riscontrata nei pazienti con un’alta quota blastica midollare.
Conclusioni
Obe-cel ha determinato un’alta incidenza di risposte durature negli adulti con B-ALL R/R, in linea con studi precedenti che utilizzavano altri prodotti CAR-T in pazienti con B-ALL R/R. Il maggior beneficio in termini di durata della risposta è stato osservato nei pazienti con carica di malattia midollare bassa/intermedia, compresi i pazienti non sottoposti a trapianto allogenico di consolidamento. A differenza di altre CAR-T, obe-cel è stato associato a un’incidenza molto bassa di effetti tossici immuno-correlati di grado 3 o superiore, sempre in correlazione con il tumor burden. (Studio finanziato da Autolus Therapeutics; FELIX numero ClinicalTrials.gov, NCT04404660.)


