Numero speciale di "Impact Factor News” n° 1 - Aprile 2021
Introduzione
I risultati dello studio KarMMa, pubblicati sul New England Journal of Medicine, confermano le potenzialità di idecabtagene vicleucel (ide-cel), CAR T diretto contro il B-cell maturation antigen (BCMA), nei pazienti affetti da mieloma multiplo recidivante/refrattario (MM R/R) ad almeno tre linee di trattamento precedenti.
Metodi
Lo studio di fase II KarMMa è stato disegnato con l’obiettivo di confermare l'efficacia e la sicurezza di ide-cel nei pazienti con MM R/R. Lo studio ha arruolato pazienti sottoposti ad almeno tre regimi precedenti, che includevano un inibitore del proteasoma, un agente immunomodulante e un anticorpo anti-CD38. I pazienti hanno ricevuto dosi target di ide-cel da 150×106 a 450×106 cellule T CAR-positive (CAR+ T). L'endpoint primario era il tasso di risposte globali (risposta parziale o migliore); tra gli endpoints secondari era compresa la valutazione del tasso di risposta completa o migliore (comprising complete response e stringent complete response).
Risultati
Dei 140 pazienti arruolati, 128 hanno ricevuto ide-cel. I pazienti inclusi avevano ricevuto una mediana di sei trattamenti (da un minimo di tre a un massimo di 16), l’84% era refrattario a tutte le tre classi di nuovi farmaci (agenti immunomodulanti, inibitori del proteasoma e anticorpo monoclonale anti-CD38), e nella maggior parte dei casi erano stati sottoposti a trapianto di cellule staminali ematopoietiche. Con un follow-up mediano di 13,3 mesi, 94 pazienti su 128 (73%) hanno avuto una risposta e 42 pazienti su 128 (33%) hanno avuto una risposta completa o migliore. Per quanto riguarda la malattia minima residua (MRD), lo stato di negatività (<10-5 delle cellule nucleate) è stato confermato in 33 pazienti, pari al 26% di tutti i 128 pazienti che erano stati trattati e al 79% dei 42 pazienti che hanno avuto una risposta completa o migliore (Figura 1). La progression-free survival mediana è stata di 8,8 mesi (95% confidence interval, CI: 5,6–11,6) nella popolazione generale, con un’overall survival mediana di circa 20 mesi nei pazienti che avevano avuto una risposta completa (Figura 2). Per quanto riguarda gli effetti collaterali, si sono verificati eventi avversi di grado 3-4 nel 99% dei pazienti trattati. In particolare, la neutropenia è stato l’evento avverso più comune, riscontrato in 117 pazienti (91%), l’anemia si è verificata in 89 pazienti (70%) e la trombocitopenia in 81 (63%). La sindrome da rilascio di citochine (CRS) è stata riportata in 107 pazienti (84%), di cui 7 (5%) hanno avuto eventi di grado 3 o superiore. Si sono verificati effetti neurotossici in 23 pazienti (18%), in quattro dei quali di grado 3 (3%); non si è verificato nessun effetto neurotossico superiore al grado 3 (Tabella 1). L'analisi della cinetica cellulare ha confermato la presenza di linfociti CAR+ T in 29 pazienti su 49 (59%) a sei mesi, e in 4 su 11 pazienti (36%) a 12 mesi dopo l'infusione.

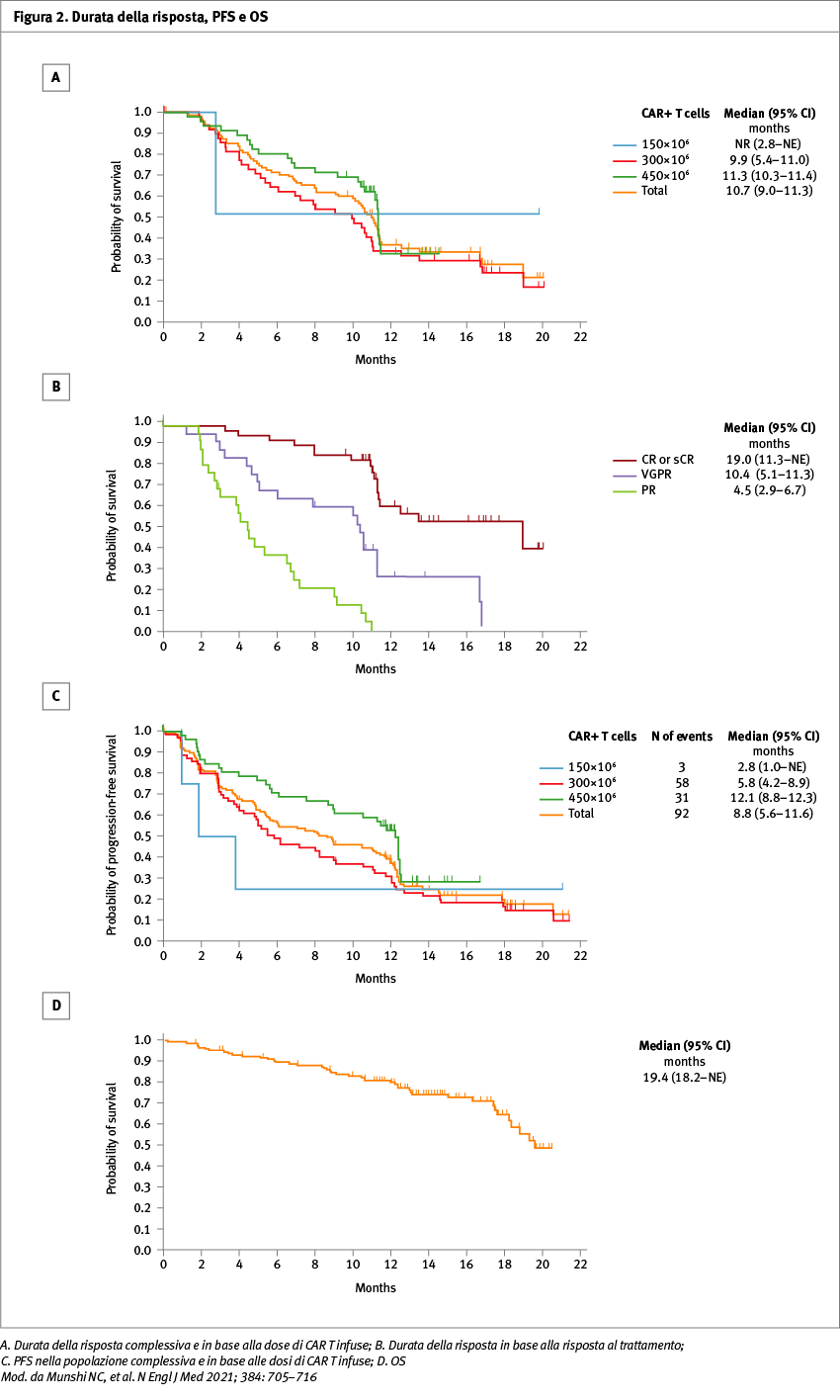

Conclusioni
Il trattamento con ide-cel ha indotto risposte in 3/4 dei pazienti affetti da MM R/R fortemente pretrattati, con raggiungimento della negatività della MRD nel 26% dei pazienti trattati. Quasi tutti i pazienti hanno avuto effetti tossici di grado 3 o 4, più comunemente ematologici e sindrome da rilascio di citochine. Lo studio KarMMA ha confermato l’efficacia di ide-cel, con una dose target di cellule compresa tra 150x106 e 450x106.


