Numero speciale di "Impact Factor News” n° 1 - Aprile 2022
Introduzione
Da tempo R-CHOP (rituximab, ciclofosfamide, doxorubicina, vincristina e prednisone) rappresenta lo standard terapeutico nel linfoma diffuso a grandi cellule B (DLBCL), con un tasso di guarigione del 60%. Lo studio di fase III POLARIX ha testato l’efficacia di polatuzumab vedotin, un anticorpo farmaco-coniugato (ADC) anti-CD79b, in combinazione con rituximab più ciclofosfamide, doxorubicina e prednisone (pola-R-CHP) rispetto a R-CHOP, con l’obiettivo di migliorare gli outcome clinici nel DLBCL in prima linea.
Metodi
POLARIX è uno studio internazionale di fase III, randomizzato, in doppio cieco, controllato con placebo per valutare l’efficacia e la sicurezza di pola-R-CHP rispetto a R-CHOP in pazienti con DLBCL precedentemente non trattato. Sono stati esclusi i pazienti con una storia di linfoma indolente e i pazienti con coinvolgimento noto del sistema nervoso centrale (SNC). 879 pazienti di età compresa tra 18 e 80 anni sono stati randomizzati con rapporto 1:1 a ricevere pola-R-CHP più un placebo di vincristina per sei cicli, seguiti da due cicli di rituximab, o a ricevere R-CHOP più un placebo di polatuzumab vedotin per sei cicli, seguiti da sei cicli di rituximab. L’outcome primario era la sopravvivenza libera da progressione (PFS), valutata dallo sperimentatore utilizzando i criteri di risposta di Lugano. Gli endpoints secondari includevano la sopravvivenza globale (OS) e la sicurezza della combinazione.
Risultati
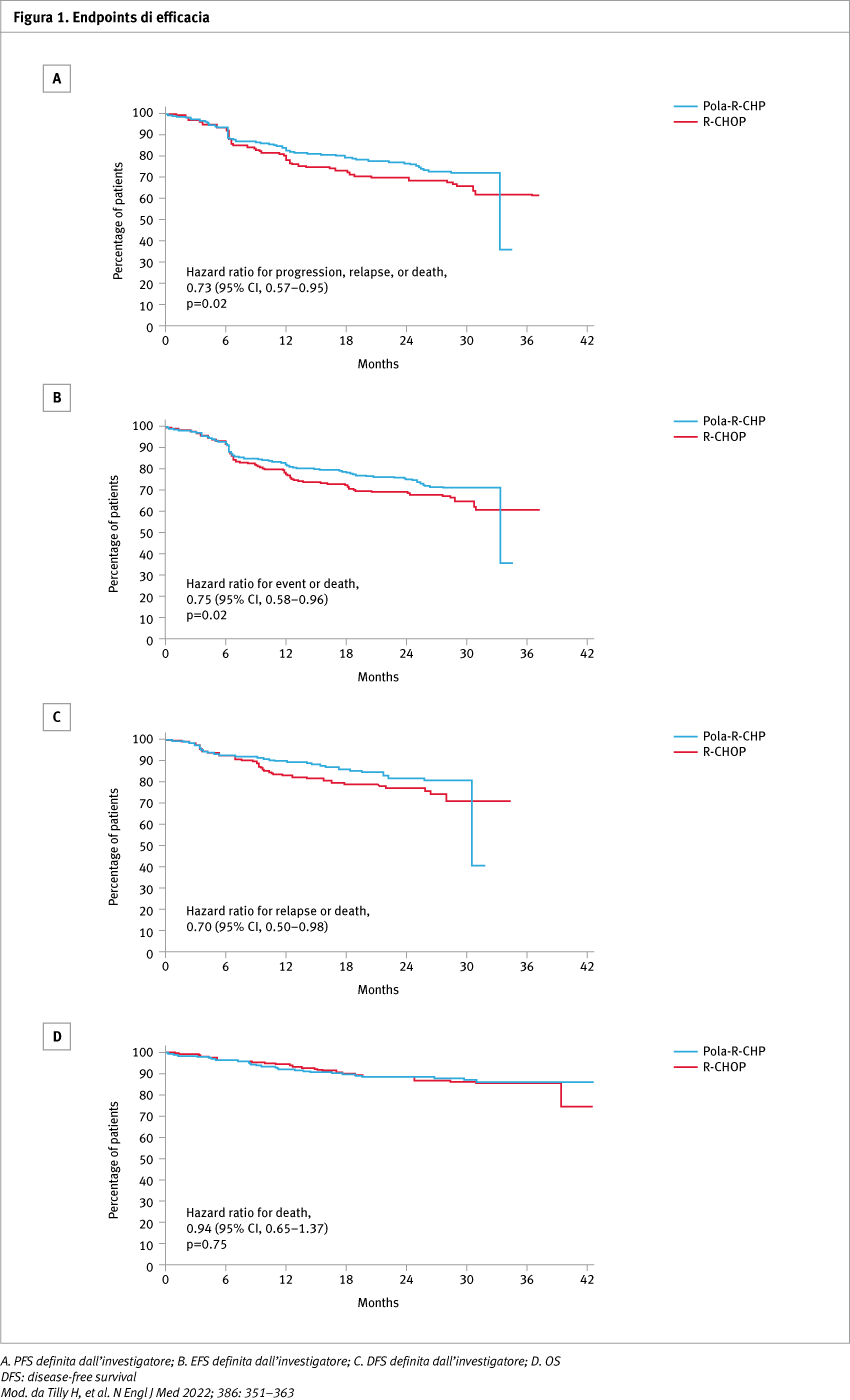
Nello studio sono stati randomizzati 879 pazienti: 440 sono stati assegnati al gruppo pola-R-CHP e 439 al gruppo R-CHOP. L’endpoint primario è stato soddisfatto: con un follow-up mediano di 28,2 mesi, la PFS a due anni era significativamente più alta nel gruppo pola-R-CHP rispetto al gruppo R-CHOP (76,7 [95% confidence interval, CI: 72,7–80,8] vs 70,2% [95% CI: 65,8–74,6] a due anni; hazard ratio, HR stratificato per progressione, recidiva o morte: 0,73 per regressione di Cox; 95% CI: 0,57–0,95; p=0,02) (Figura 1). La OS a due anni non differiva significativamente tra i gruppi, con valori di 88,7% [95% CI 85,7–91,6] nel gruppo pola-R-CHP e di 88,6% [95% CI 85,6–91,6] nel gruppo R-CHOP (HR per morte 0,94; 95% CI 0,65–1,37; p=0,75). Il profilo di sicurezza era simile nei due gruppi. La maggior parte dei pazienti ha ricevuto tutte e sei le dosi di polatuzumab vedotin (91,7%) o vincristina (88,5%) nei bracci pola-R-CHP e R-CHOP, rispettivamente, con l'88,0 e l'85,9% che hanno ricevuto tutti gli otto cicli di trattamento. Gli eventi avversi di grado 3-4 più comuni nei bracci pola-R-CHP e R-CHOP sono stati neutropenia (28,3 e 30,8%), neutropenia febbrile (13,8 e 8,0%) e anemia (12,0 e 8,4%). La neuropatia periferica di qualsiasi grado e la neuropatia periferica di grado ≥2 sono state riportate con tassi simili in entrambi i gruppi pola-R-CHP e R-CHOP (52,9 vs 52,9% e 13,8 vs 16,7%). I tempi mediani di insorgenza e risoluzione nei gruppi pola-R-CHP e R-CHOP sono stati di 2,3 vs 1,9 mesi e 4,0 vs 4,6 mesi, rispettivamente. Lo 0,2% dei pazienti nel gruppo pola-R-CHP e lo 0,9% nel gruppo R-CHOP ha interrotto il trattamento a causa di neuropatia periferica; un minor numero di pazienti nel gruppo pola-R-CHP ha avuto una riduzione della dose a causa di neuropatia periferica rispetto al gruppo R-CHOP (4,4 vs 8,0%).
Conclusioni
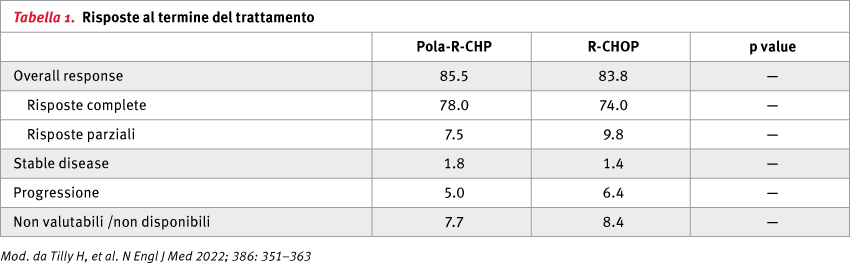
I pazienti nel gruppo pola-R-CHP avevano un rischio di progressione della malattia, recidiva o morte inferiore del 27% rispetto al gruppo R-CHOP e pola-R-CHP era associato a un incremento statisticamente significativo della PFS. Sebbene i tassi di risposte complete (RC) non differiscano significativamente tra i due bracci di trattamento, l'event-free survival (EFS) era significativamente più alta con pola-R-CHP e le risposte sembravano essere più durature nei pazienti che avevano raggiunto la RC nel gruppo pola-R-CHP rispetto al gruppo R-CHOP (Tabella 1).